题目内容
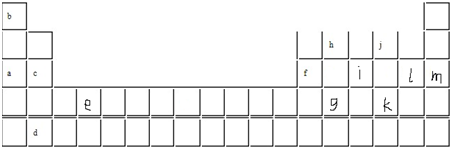
短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则叙述正确的是
- A.原子半径A>B>D>C
- B.原子序数d>c>b>a
- C.离子半径C>D>B>A
- D.单质的还原性A>B>D>C
C
aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+3=d+1。其中A和B属于金属,位于同一周期,且B在A的右侧。C和D是非金属,位于同一周期,且位于A和B的上一周期,其中C位于D的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,氢化物的稳定性也是逐渐增强的。非金属性越强,相应阴离子的还原性就越弱,所以选项C是正确的,AD不正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径应该是A>B>C>D,答案选C。
aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+3=d+1。其中A和B属于金属,位于同一周期,且B在A的右侧。C和D是非金属,位于同一周期,且位于A和B的上一周期,其中C位于D的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,氢化物的稳定性也是逐渐增强的。非金属性越强,相应阴离子的还原性就越弱,所以选项C是正确的,AD不正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径应该是A>B>C>D,答案选C。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
已知短周期元素的离子aA+、cC2-、bB3+、dD-具有相同的电子层结构,则下列叙述正确的是( )
A、25℃时,bB3+、dD-在
| ||||
| B、在AD溶液中存在:D-+H2O?HD+OH-,故其溶液呈碱性 | ||||
| C、离子半径:cC2->dD->bB3+>aA+ | ||||
D、电解AD水溶液的化学方程式为:2AD+2H2O
|