题目内容
【题目】工业合成氨的反应如下:N2 + 3H2 ![]() 2NH3。
2NH3。
某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率 v(N2) = 。
(2)250s时,H2的转化率为 。
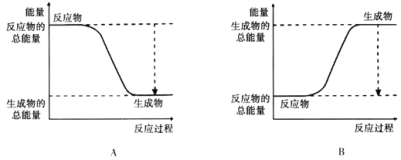
(3)已知![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。
(4)为加快反应速率,可以采取的措施
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
(5)下列说法错误的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.上述条件下,N2不可能100%转化为NH3
C.为了提高N2的转化率,应适当提高H2的浓度
D.250~350s生成物浓度保持不变,反应停止
【答案】(1)1.2×10-3mol/(L·s );
(2)30%(3)46;A;(4)b;(5)d
【解析】
试题分析:(1)0~50s内的平均反应速率 v(NH3) =![]() =
=![]() =2.4×10-3mol/(L·s ),因此v(N2)= 1.2×10-3mol/(L·s ),故答案为:1.2×10-3mol/(L·s );
=2.4×10-3mol/(L·s ),因此v(N2)= 1.2×10-3mol/(L·s ),故答案为:1.2×10-3mol/(L·s );
(2)250s时,生成了氨气0.4mol,反应的氢气的物质的量为0.6mol,H2的转化率为![]() ×100%=30%,故答案为:30%;
×100%=30%,故答案为:30%;
(3)根据N2 + 3H2 ![]() 2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为
2NH3,反应的△H=(946kJ/mol+3×436kJ/mol)-6×391kJ/mol=-92 kJ/mol,因此生成1molNH3过程中的热量变化为![]() ×92 kJ =46 kJ,该反应为放热反应,故选A,故答案为:46;A;
×92 kJ =46 kJ,该反应为放热反应,故选A,故答案为:46;A;
(4)a.降低温度,反应速率减慢,错误;b.增大压强,反应速率加快,正确;c.恒容时充入He气,反应物的浓度不变,反应速率不变,错误;d.恒压时充入He气,反应物的浓度减小,反应速率减慢。错误;e.及时分离NH3,生成物的浓度减小,反应速率减慢,故选b;
(5)A.使用催化剂,反应速率加快,提高了生产效率,正确;B.反应为可逆反应,N2不可能100%转化为NH3,正确;c.适当提高H2的浓度,平衡正向移动,可以提高N2的转化率,正确;D.250~350s生成物浓度保持不变,反应达到了化学平衡状态,但反应未停止,错误;故选d。

 阅读快车系列答案
阅读快车系列答案