��Ŀ����
����Ŀ���衢�ס����ȶ��ǵ������ڵķǽ���Ԫ�أ������ڹ�ũҵ�����ж�����Ҫ����;��
��1�� ��̬��ԭ�ӵĵ����Ų�ͼΪ_________________________________________________����Ļ�̬ԭ��������ߵĵ������ڿռ���________________����չ����ԭ�ӹ����________________�Ρ�
��2���衢�ס���ĵ�һ�������ɴ�С��˳��Ϊ________________��
��3����������Cl2��Ӧ����������PC13��PC15�����и�ԭ�Ӿ�����8�����ȶ��ṹ�Ļ������У�Pԭ�ӵ��ӻ��������Ϊ________________������ӵĿռ乹��Ϊ________________��
��4��H3PO4Ϊ��Ԫ��ǿ�ᣬ��Fe3+�γ�H3[Fe(PO4)2]�������ʳ������ڱ���Һ�е�Fe3+����̬Fe3+��������Ų�ʽΪ__________��PO43-��Ϊ___________ΪFe3+�ṩ________________��
��5��������BP����һ�ֳ�Ӳ��ĥͿ����ϣ���ͼΪ�侧������ԭ������ԭ������ľ���Ϊa cm�� ��Mg/mol��ʾ�����Ħ��������NA��ʾ�����ӵ�������ֵ������������ܶ�Ϊ_________g/cm3��

���𰸡� ![]() 3 ���� P>S>Si sp3�ӻ� ������ [Ar]3d5 ���� �µ��Ӷ�
3 ���� P>S>Si sp3�ӻ� ������ [Ar]3d5 ���� �µ��Ӷ� 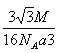
���������衢�ס����ȶ��ǵ������ڵķǽ���Ԫ�أ������ڹ�ũҵ�����ж�����Ҫ����;��
��1�� ��̬��ԭ�ӵĵ����Ų�ͼΪ![]() ����Ļ�̬ԭ��������ߵĵ�������3p������ڿռ���3����չ����ԭ�ӹ���������Ρ�
����Ļ�̬ԭ��������ߵĵ�������3p������ڿռ���3����չ����ԭ�ӹ���������Ρ�
��2��һ��أ��ǽ�����Խǿ��Ԫ�أ����һ������Խ�ߡ�������3p������ڽ��ȶ������״̬���������һ�����ܸ��������ڵ�Ԫ�ء��衢�ס���ĵ�һ�������ɴ�С��˳��ΪP>S>Si ��
��3����������Cl2��Ӧ����������PC13��PC15������PC13��ԭ�Ӿ�����8�����ȶ��ṹ�������м۲���Ӷ���n=![]() =4��Pԭ�ӵ��ӻ��������Ϊsp3�ӻ�������ӵĿռ乹��Ϊ�����Ρ�
=4��Pԭ�ӵ��ӻ��������Ϊsp3�ӻ�������ӵĿռ乹��Ϊ�����Ρ�
��4��H3PO4Ϊ��Ԫ��ǿ�ᣬ��Fe3+�γ�H3[Fe(PO4)2]�������ʳ������ڱ���Һ�е�Fe3+����̬Fe3+��������Ų�ʽΪ[Ar]3d5��PO43-��Ϊ����ΪFe3+�ṩ�µ��Ӷԡ�
��5���Ѹþ����ֳ�8��С�����壬����һ��С������Ķ��������֮��ľ���Ϊ��ԭ������ԭ������ľ��룬��ԭ������ԭ������ľ���Ϊa cm���ڸþ����У���4��Bԭ�Ӻ�4��Pԭ���� ��Mg/md��ʾ�����Ħ��������NA��ʾ�����ӵ�������ֵ����þ����ı߳�Ϊ2x����x2+2x2=(2a)2����֮��x=![]() a���þ��������Ϊ��2x��3=
a���þ��������Ϊ��2x��3=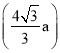 3��1mol�þ����к�4molBP������Ϊ4M g����������ܶ�Ϊ=
3��1mol�þ����к�4molBP������Ϊ4M g����������ܶ�Ϊ=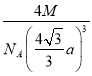 g/cm3=
g/cm3=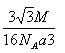 g/cm3��
g/cm3��

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�����Ŀ��ʵ������ȡ����������Ũ����Ͷ������̷�Ӧ����������з�Ӧ��KClO3+6HCl��Ũ���TKCl+3Cl2��+3H2O���÷�Ӧ���ŵ��Ƿ�Ӧ���������ٶȿ졢������ȣ�ͼ��ʵ�������ô˷�Ӧ�Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ��� 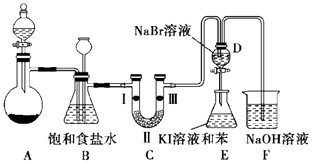
��1��������Ӧ�������������ǻ�ԭ��������Ӧ����������Ȼ�ԭ����� 1mol����ת�Ƶĵ�����ĿΪ ��
��2��װ��B�������� �� ʵ�����ʱC�п��ܷ�����������д����������ʱB�е����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η�����ѡ��a����b����c����
a | b | c | |
�� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��4�����װ��D��E ��Ŀ����Ϊ�˱Ƚ�Cl2��Br2��I2��������ǿ���� ��֪Br2 ��ˮ��Һ��Ũ�Ȳ�ͬ�����ֳ�ɫ�����ɫ��I2������ˮ�����ܱ����� I2 �ı���ҺΪ�Ϻ�ɫ������D�л���ͨ������Cl2ʱ�����Կ�����ɫ��Һ��Ϊ����ɫ��˵�� Cl2�������Դ��� Br2 �� ��д��D�ж�Ӧ�����ӷ���ʽ����˫���ŷ���ʾ������ת������� �� �������� D�е�������Һ����E�У���E���۲쵽E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ���������� ��ܡ����ܡ���˵��Br2�������Դ���I2 ��
��5��װ��F�������dz�ȥ��Ⱦ�Ե����ʣ�Cl2��Br2 �ȣ�����֪Cl2��NaOH��Ӧʱ�����п�����NaCl��NaClO��NaClO3 �� �� ![]() ֵ���¶ȸߵ��йأ� ���ձ���װ��500mL0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����ΪL������Cl2����ˮ����
ֵ���¶ȸߵ��йأ� ���ձ���װ��500mL0.2mol/L ��NaOH��Һ�����������ձ���µ�Cl2�����ΪL������Cl2����ˮ����