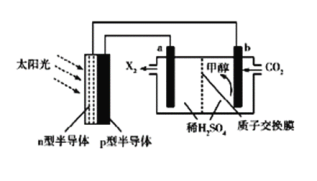
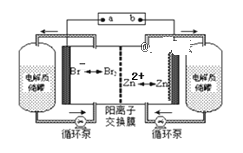
题目内容
【题目】下列化学用语正确的是
A. HSO3-+ H2O![]() SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
SO32- + OH- B. Al3+ + 3H2O == 3H+ + Al(OH)3↓
C. NaHCO3 == Na+ + HCO3- D. H2S![]() 2H+ + S2-
2H+ + S2-
【答案】C
【解析】
A、HSO3-在水溶液中既存在电离HSO3-![]() SO32- + H+,也存在水解HSO3-+ H2O
SO32- + H+,也存在水解HSO3-+ H2O![]() H2SO3 + OH-, 以电离为主,所以HSO3-是酸性的;故A错误;
H2SO3 + OH-, 以电离为主,所以HSO3-是酸性的;故A错误;
B、Al3+水解为可逆过程,Al3+ + 3H2O![]() 3H+ + Al(OH)3↓,故B错误;
3H+ + Al(OH)3↓,故B错误;
C、碳酸氢钠是强电解质,溶于水完全电离成钠离子和碳酸氢根离子,NaHCO3 == Na+ + HCO3-,故C正确;
D、H2S为弱酸,应分步电离H2S![]() H+ + HS-,HS-
H+ + HS-,HS-![]() H+ + S2-,故D错误;
H+ + S2-,故D错误;
综上所述,本题正确答案为C。

 巧学巧练系列答案
巧学巧练系列答案【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______0(填“>”或“<”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度 c.增大B的浓度 d.选择高效催化剂
【题目】ClO2是一种易溶于水难溶于有机溶剂的气体,在自来水消毒和果蔬保鲜等方面应用广泛。某同学在实验室中制取ClO2,并探究其性质。回答下列问题:
Ⅰ.ClO2的制备
实验室制备ClO2的反应原理为2NaClO2 + Cl2 = 2ClO2 + 2NaCl,装置如下图所示:

(1)装置A烧瓶中发生反应的离子方程式为___________________________。
(2)装置B中盛放的最佳试剂为________(填字母代号);
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
(3)控制滴加浓盐酸的速率,使产生的气体缓缓通过装置D,其目的是______________________________________________________________。
Ⅱ.探究ClO2的氧化性,按下图所示装置进行实验:

(4)完成下列表格中的空格:
洗气瓶 | 现象或作用 | 解释原因 |
X | 溶液由浅绿色变成棕黄色 | 反应的离子方程式为_________________ |
Y | 溶液中出现淡黄色沉淀 | 反应的离子方程式为______________ |
Z | NaOH溶液的作用是________________________ | 反应的化学方程式为 2NaOH + 2ClO2 = NaClO2 + NaClO3 + H2O |
Ⅲ.测定水中的浓度
用碘量法测定水中ClO2浓度的实验步骤:取100 mL的水样加稀硫酸调节pH至2~3,加入一定量的KI溶液,充分振荡后,再加入几滴指示剂,用2.0×10-4 mol/L标准Na2S2O3溶液进行滴定(已知:2ClO2 + 10I- + 8H+ = 5I2 + 2Cl- + 4H2O ;2S2O32- + I2 = S4O62- + 2I- )。
(5)若达到滴定终点时,消耗15.00 mL 标准Na2S2O3溶液,则水样中ClO2的浓度是 _________ mol/L。