题目内容
8.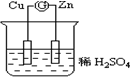 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
分析 铜、锌、稀硫酸构成的原电池中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答 解:铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,
故答案为:负;氧化;Zn-2e-=Zn2+;2H++2e-=H2↑;有气泡产生.
点评 本题考查了原电池原理,明确正负极上得失电子、反应类型、电极反应式的书写即可解答,难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
18.应用Na2CO3和NaHCO3的下列性质设计实验,不能够鉴别Na2CO3和NaHCO3固体的是( )
| A. | 水溶性 | B. | 热稳定性 | C. | 与酸反应 | D. | 焰色反应 |
19.表中列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式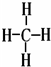 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式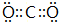 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式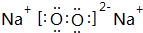 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式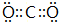 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图
 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
16.A、B、C、D、E五种元素的原子的原子序数都小于18,且具有相同的电子层,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序( )
| A. | B、A、D、C、E | B. | C、D、B、A、E | C. | B、A、C、D、E | D. | C、D、A、B、E |
3.下列各组物质的晶体中,化学键和晶体类型完全相同的是( )
| A. | 二氧化碳和二氧化硅 | B. | 氯化钠和氯化氢 | ||
| C. | 氢氧化钾和氯化钾 | D. | 二氧化硫和水 |
20.1.8g某金属与足量盐酸充分反应,产生2.24LH2(标况下),则该金属是( )
| A. | Zn | B. | Mg | C. | Al | D. | Fe |