题目内容
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 | 溶液为 黄色 |
| ② | 先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 | 溶液为 黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为_________________________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
| 操作 | 现象 |
| | |
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
| 操作 | 现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是___________________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:______________________________________________________________________。
环节一:均为ⅦA族元素,其单质的氧化性均较强环节三:(1)2Fe2++Br2=2Fe3++2Br-操作 现象 取少量试管①中的黄色溶液于试管③中,滴加少量KSCN溶液,振荡 溶液变为红色
(2)碘水与FeCl2溶液发生反应,FeCl3溶液呈黄色 亚铁离子与空气接触会被氧化,加入的乙酸乙酯既可作萃取剂又能起到液封的作用,防止空气对实验产生干扰
(3)同一主族元素从上到下,原子核外的电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性逐渐减弱
解析

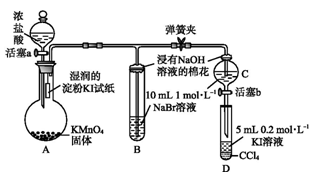
研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
| 滴入 KMnO4认溶液的次序(每滴溶液等体积) | KMnO4溶液紫色褪去的时间 |
| 先滴入第 1 滴 | 1min |
| 褪色后再滴入第 2 滴 | 15s |
| 褪色后再滴入第 3 滴 | 3s |
| 褪色后再滴入第 4 滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因________________________________________。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠来标定高锰酸钾济液的浓度。他们准确称取2.680g纯净的草酸钠配成500mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
①高锰酸钾溶液应装在______(填下途中的仪器编号)。
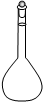
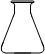

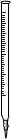
甲 乙 丙 丁
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是______________。
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为________________。
(附原子相对质量K=39Mn=55O=16 Na=23C=12)
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ·mol-1
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1 |
用坩埚钳夹住一小块刚用盐酸处理过的铝箱,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验中有关问题的解释不正确的是
| A.铝箔熔化,失去金属光泽 | B.铝在空气中能很快形成氧化膜 |
| C.氧化铝的熔点比铝高 | D.氧化铝与盐酸不反应 |
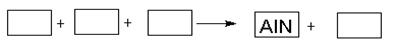
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。