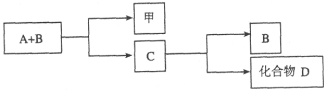
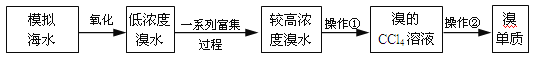
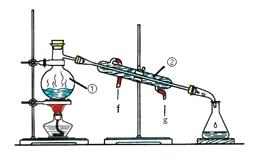
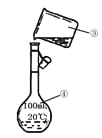
题目内容
【题目】氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是( )
A. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B. 四种溶液中,水的电离程度最大的是NaClO
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
【答案】A
【解析】
浓度相同的四种钠盐,pH越大,说明(碱性溶液)酸根的水解能力越强,对应的酸的酸性越弱,故酸性:H2SO3﹥H2CO3﹥HClO﹥HCO3-。
A、氯水中存在平衡![]() ,由于酸性:HCl﹥H2CO3﹥HClO,则NaHCO3会与盐酸发生反应,使上述反应向生成次氯酸的方向移动,增大了氯水中次氯酸的浓度,故A正确;
,由于酸性:HCl﹥H2CO3﹥HClO,则NaHCO3会与盐酸发生反应,使上述反应向生成次氯酸的方向移动,增大了氯水中次氯酸的浓度,故A正确;
B、NaHSO3溶液呈酸性,说明HSO3-以电离生成H+为主,会抑制水的电离,其它三种强碱弱酸盐中酸根的水解会促进水的电离,水电离出的![]() ,且其pH越大,水的电离程度越大,则四种溶液中,水的电离程度最大的是Na2CO3,故B错误;
,且其pH越大,水的电离程度越大,则四种溶液中,水的电离程度最大的是Na2CO3,故B错误;
C、酸性:H2SO3﹥H2CO3﹥HClO,则相同物质的量浓度的三种溶液,pH最大的是HClO,故C错误;
D、NaHSO3溶液中![]() 的电离、水解都只占一小部分,且以电离为主,而H+和OH-还有部分由水的电离产生,则溶液中离子浓度大小顺序为c(Na+)> c(HSO3-)> c(H+) >c(SO32-)>c(OH-),故D错误;
的电离、水解都只占一小部分,且以电离为主,而H+和OH-还有部分由水的电离产生,则溶液中离子浓度大小顺序为c(Na+)> c(HSO3-)> c(H+) >c(SO32-)>c(OH-),故D错误;
答案为A。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目