题目内容
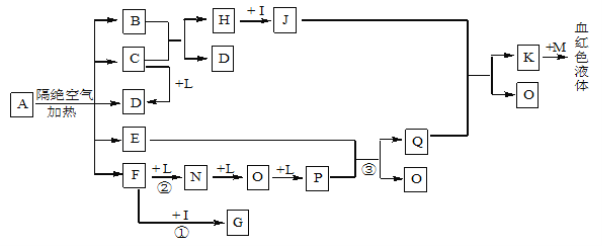
【题目】已知A为一种盐,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
(1)写出D的电子式为_______________;
(2)写出反应①的化学方程式: ;写出反应②的化学方程式: ;反应③中氧化剂和还原剂的物质的量之比为_________________;
(3)将等体积、等浓度的G和F的溶液混合,溶液显碱性,则溶液中离子浓度从大到小的顺序为 ______________________;
(4)检验J中阳离子的实验方法为 ;
(5)已知B中氧元素的质量分数为22.2﹪,且A分解产生的各物质的物质的量之比为n(B):n(C): n(D):n(E):n(F)=1:2:2:1:2,则A的化学式为_________________________
【答案】
(1)![]() ;(2)4NH3+3O2=2N2+6H2O;1:2;
;(2)4NH3+3O2=2N2+6H2O;1:2;
(3)c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)取少量样品于试管中,如果先加入KSCN无明显现象,再加入少量氯水溶液出现红色证明存在Fe2+或者取样后滴入铁氰化钾溶液,如果出现蓝色沉淀也可证明存在Fe2+;(5)(NH4) 2Fe(C2O4)2 ;
【解析】
试题分析:依据K与M反应生成血红色溶液,说明K是三价铁盐溶液,M的焰色反应,M为紫色为KSCN;I为常见无氧强酸为盐酸HCl,依据FNOP的转化关系可以推断L为O2,E常温常压下为无色无味的液体推断为H2O,反应①常用于气体F的检验,F和I(HCl)反应,说明F为NH3,G为NH4Cl;F和氧气反应生成的单质N为N2、O为NO,P为NO2,Q为HNO3;依据J和硝酸反应生成的K,是发生氧化还原反应的结果,H和I(HCl)反应推断H为Fe,J为FeCl2,题干中的信息中CD都是无色气体,B+C=Fe+D,能生成铁说明该反应是还原剂还原铁的氧化物生成,所以判断C为CO,D为CO2,B为铁的氧化物,B中氧元素的质量分数为22.2%,则B为FeO。
(1)D为CO2,电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应②是氨气的催化氧化,反应的化学反应方程式:4NH3+3O2=2N2+6H2O; 反应③是二氧化氮与水反应生成一氧化氮和硝的反应,根据方程式可知3NO2+H2O=NO+2HNO3,氧化剂和还原剂的物质的量之比为1:2,故答案为:4NH3+3O2=2N2+6H2O;1:2;
(3)F为NH3,G为NH4Cl,将等体积、等浓度的G和F的溶液混合,溶液显碱性,说明氨水的电离程度大于铵根离子的水解程度,所以溶液中离子浓度从大到小的顺序为 c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)J为FeCl2,检验J中阳离子的实验方法为取少量样品于试管中,先加入KSCN无明显现象,再加入少量氯水溶液出现红色,故答案为:取少量样品于试管中,先加入KSCN无明显现象,再加入少量氯水溶液出现红色;
(5)A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,即FeO:CO:CO2:H2O:NH3=1:2:2:2:2;依据原子守恒和化合价代数和为0,结合推断中生成物质的性质推断出A的化学式为:(NH4)2Fe(C2O4)2,故答案为:(NH4)2Fe(C2O4)2。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案