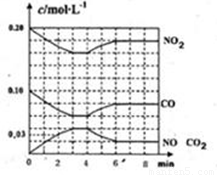
��Ŀ����
�о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ�������������Ҫ���壮
��1��������CO��SO2�̵�����Ⱦ��һ�ַ����ǽ����ڴ���������ת��Ϊ����S��
��֪����CO��g��+ O2��g��=CO2��g����H=-283.0KJ?mol-1
O2��g��=CO2��g����H=-283.0KJ?mol-1
��S��s��+O2��g��=SO2��g����H=-296.0KJ?mol-1
�˷�Ӧ���Ȼ�ѧ����ʽ��______��
��2��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���壮��֪��
��CO��g��+NO2��g��=NO��g��+CO2��g����H=-a KJ?mol-1��a��0��
��2CO��g��+2NO ��g��=N2��g��+2CO2��g����H=-b KJ?mol-1��b��0��
���ñ�״���� 3.36L CO��ԭNO2��N2��CO��ȫ��Ӧ��������������ת�Ƶ��ӵ����ʵ���Ϊ______mol���ų�������Ϊ______KJ���ú���a��b�Ĵ���ʽ��ʾ����
��3����CH4����ԭNOxҲ�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574KJ?mol-1��
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=����
��1mol CH4��ԭNO2��N2���������зų�������Ϊ867KJ�����H2=______��
�⣺��1����CO��g��+ O2��g��=CO2��g����H=-283.0KJ?mol-1
O2��g��=CO2��g����H=-283.0KJ?mol-1
��S��s��+O2��g��=SO2��g����H=-296.0KJ?mol-1
������ʽ�١�2-�ڵ�2CO��g��+SO2��g��=S��s��+2CO2��g����H1=��-283.0KJ?mol-1
����2-��-296.0KJ?mol-1��=-270KJ?mol-1��
�������Ȼ�ѧ��Ӧ����ʽΪ��2CO��g��+SO2��g��=S��s��+2CO2��g����H1=-270KJ?mol-1��
�ʴ�Ϊ��2CO��g��+SO2��g��=S��s��+2CO2��g����H1=-270KJ?mol-1��
��2����CO��g��+NO2��g��=NO��g��+CO2��g����H=-a KJ?mol-1��a��0��
��2CO��g��+2NO ��g��=N2��g��+2CO2��g����H=-b KJ?mol-1��b��0��
������ʽ�١�2+�ڵ�4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a�� KJ?mol-1��2+��-b KJ?mol-1��=
-��2a+b��KJ?mol-1
�������Ȼ�ѧ��Ӧ����ʽΪ��4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=-��2a+b��KJ?mol-1��
���ݷ���ʽ֪ת�Ƶ��ӵ����ʵ���=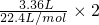 =0.3mol���ų�������=
=0.3mol���ų�������= =
=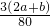 kJ��
kJ��
�ʴ�Ϊ��0.3��3��2a+b��/80��
��3����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574KJ?mol-1��
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=����
������ʽ��+�ڵ�2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=��H1+��H2��
���ݷ���ʽ֪��1mol CH4��ԭNO2��N2���������зų�������Ϊ867KJ�����ԡ�H2=-867KJ/mol��2-��-574KJ/mol��=-1160KJ/mol
�ʴ�Ϊ��-1160KJ/mol��
��������1�����ø�˹���ɽ�����д��
��2������һ����̼��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3�����ø�˹���ɽ��м��㣮
���������⿼���˸�˹���ɵ��йؼ��㣬�����ø�˹������д����Ӧ��֮��Ĺ�ϵʽ�ǽⱾ��ؼ����ѶȲ���
 O2��g��=CO2��g����H=-283.0KJ?mol-1
O2��g��=CO2��g����H=-283.0KJ?mol-1��S��s��+O2��g��=SO2��g����H=-296.0KJ?mol-1
������ʽ�١�2-�ڵ�2CO��g��+SO2��g��=S��s��+2CO2��g����H1=��-283.0KJ?mol-1
����2-��-296.0KJ?mol-1��=-270KJ?mol-1��
�������Ȼ�ѧ��Ӧ����ʽΪ��2CO��g��+SO2��g��=S��s��+2CO2��g����H1=-270KJ?mol-1��
�ʴ�Ϊ��2CO��g��+SO2��g��=S��s��+2CO2��g����H1=-270KJ?mol-1��
��2����CO��g��+NO2��g��=NO��g��+CO2��g����H=-a KJ?mol-1��a��0��
��2CO��g��+2NO ��g��=N2��g��+2CO2��g����H=-b KJ?mol-1��b��0��
������ʽ�١�2+�ڵ�4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a�� KJ?mol-1��2+��-b KJ?mol-1��=
-��2a+b��KJ?mol-1
�������Ȼ�ѧ��Ӧ����ʽΪ��4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=-��2a+b��KJ?mol-1��
���ݷ���ʽ֪ת�Ƶ��ӵ����ʵ���=
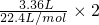 =0.3mol���ų�������=
=0.3mol���ų�������= =
=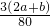 kJ��
kJ���ʴ�Ϊ��0.3��3��2a+b��/80��
��3����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574KJ?mol-1��
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=����
������ʽ��+�ڵ�2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=��H1+��H2��
���ݷ���ʽ֪��1mol CH4��ԭNO2��N2���������зų�������Ϊ867KJ�����ԡ�H2=-867KJ/mol��2-��-574KJ/mol��=-1160KJ/mol
�ʴ�Ϊ��-1160KJ/mol��
��������1�����ø�˹���ɽ�����д��
��2������һ����̼��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��3�����ø�˹���ɽ��м��㣮
���������⿼���˸�˹���ɵ��йؼ��㣬�����ø�˹������д����Ӧ��֮��Ĺ�ϵʽ�ǽⱾ��ؼ����ѶȲ���

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
 ����ԭNOxҲ�������������������Ⱦ�����磺
����ԭNOxҲ�������������������Ⱦ�����磺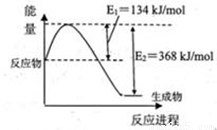
 N2(g)��2CO2(g)�ġ�H��
��
N2(g)��2CO2(g)�ġ�H��
��