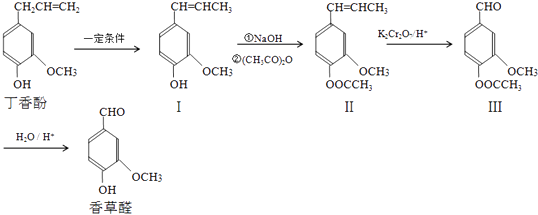
��Ŀ����
����Ŀ����.��֪ij��ɫ��Һ�п��ܺ���Na+��NH4+��Ba2+��Cu2+��SO42����SO32����Cl����Br����CO32���е������֣�Ϊ�������к��е����ӣ���������ʵ�飺
��ȡ10mL��Һ������������ˮ��������������ټ���CCl4��Һ�ֲ㣬�²�Ϊ�Ⱥ�ɫ��
�ڷ�Һ�����ٵ��ϲ���Һ�м�������BaCl2��HCl��Һ��������ɫ����2.33g��
����ȡ10mLԭ��Һ�����������Ũ����������Һ�����ȣ��ռ�����״����448mL���塣
�ش��������⣺
��1��һ�������ڵ�����Ϊ��____________��
��2����Ҫͨ����ɫ��Ӧ��ȷ���Ƿ����Na+��_________����ǡ��������Ҫ˵��ԭ��_________��
��.���ӹ�ҵ����30%��FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣
��1��FeCl3��Һ�����ͭ������Ӧ�Ļ�ѧ��Ӧ����ʽ��__________________ ��
��2��ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ�������»���Ȼ�����Һ�����������в��裺
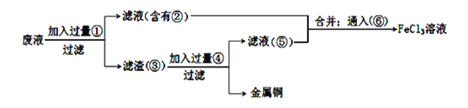
����ʵ���м�������ɵ��й����ʵĻ�ѧʽΪ��_________ ����____________��
������Һ���м�������������Һ����ʵ������Ϊ______________________ ��
���𰸡� Ba2+��Cu2+��CO32- �� ����غ� 2FeCl3+Cu = 2FeCl2+CuCl2 FeCl2 HCl �Ȳ�����ɫ������Ѹ�ٱ����ɫ��������ɫ����
����������. ��ɫ��Һ��Cu2+����ȡ10mL��Һ������������ˮ���������������һ������CO32����������CO32�������ɶ�����̼���壬�ټ���CCl4��Һ�ֲ㣬�²�Ϊ�Ⱥ�ɫ������ȷ���Ƿ���SO32������һ������Br������Ϊ��ԭ��ǿ�ڣ�����SO32��������������SO32����Ӧ����SO42��������Br����Ӧ������ʹ���Ȼ�̼���ԳȺ�ɫ���ڷ�Һ�����ٵ��ϲ���Һ�м�������BaCl2��HCl��Һ��������ɫ����2.33g��Ϊ0.01mol BaSO4����ԭ��Һ�п��ܺ���0.01mol SO42����SO32������һ������Ba2+������ȡ10mLԭ��Һ�����������Ũ����������Һ�����ȣ��ռ�����״����448mL���壬����Ϊ�����������ʵ���Ϊ0.02mol����ԭ��Һֻ����0.02mol NH4+�����������ƶϿ�֪��n(-)=2n(SOx2��)+n(Br��)= 2![]() 0.01mol+0.01mol=0.03mol��n(+)=n(NH4+)= 0.02mol������Һ��һ������Na+����ȷ����Һ���Ƿ���Cl�����ɴ˿�֪��1��һ�������ڵ�����Ϊ��Ba2+��Cu2+��CO32-����2������Ҫͨ����ɫ��Ӧ��ȷ���Ƿ����Na+�𣬸��ݵ���غ��֪�������ж������������ӣ������������������һ��С����������������������������ϵ���غ㣻��.��1��FeCl3��Һ�����ͭ������Ӧ�����Ȼ�ͭ���Ȼ���������Ӧ�Ļ�ѧ��Ӧ����ʽ��2FeCl3+Cu = 2FeCl2+CuCl2����2��ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl2��������Ģ����۷�Ӧ����Fe2+��Cu�����˵õ���Һ���Т�FeCl2���������к���Fe��Cu����Ҫ��ȥ���е�Feѡ�â����ᣬȻ����ˣ���Һ����ҪҲΪFeC12����Һ���ϲ��ڢ�ͨ��������õ�FeCl3��Һ���ʢڻ�ѧʽΪFeCl2���ܻ�ѧʽΪHCl��������Һ���м�������������Һ����ʵ������Ϊ���Ȳ�����ɫ������Ѹ�ٱ����ɫ��������ɫ������
0.01mol+0.01mol=0.03mol��n(+)=n(NH4+)= 0.02mol������Һ��һ������Na+����ȷ����Һ���Ƿ���Cl�����ɴ˿�֪��1��һ�������ڵ�����Ϊ��Ba2+��Cu2+��CO32-����2������Ҫͨ����ɫ��Ӧ��ȷ���Ƿ����Na+�𣬸��ݵ���غ��֪�������ж������������ӣ������������������һ��С����������������������������ϵ���غ㣻��.��1��FeCl3��Һ�����ͭ������Ӧ�����Ȼ�ͭ���Ȼ���������Ӧ�Ļ�ѧ��Ӧ����ʽ��2FeCl3+Cu = 2FeCl2+CuCl2����2��ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl2��������Ģ����۷�Ӧ����Fe2+��Cu�����˵õ���Һ���Т�FeCl2���������к���Fe��Cu����Ҫ��ȥ���е�Feѡ�â����ᣬȻ����ˣ���Һ����ҪҲΪFeC12����Һ���ϲ��ڢ�ͨ��������õ�FeCl3��Һ���ʢڻ�ѧʽΪFeCl2���ܻ�ѧʽΪHCl��������Һ���м�������������Һ����ʵ������Ϊ���Ȳ�����ɫ������Ѹ�ٱ����ɫ��������ɫ������

����Ŀ����֪��2CH3OH��g��CH3OCH3��g��+H2O��g����H=��25kJ/mol��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£���1L���ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c/��molL��1�� | 0.8 | 1.24 | 1.24 |
����˵����ȷ���ǣ� ��
��ƽ��������¶ȣ�ƽ�ⳣ����400
��ƽ��ʱ��c��CH3OCH3��=1.6mol/L
��ƽ�ⅼ����Ӧ����������������20kJ
��ƽ��ʱ���ټ�������ʼ������CH3OH������ƽ���CH3OHת��������
�ݴ�ʱ�̷�Ӧ�ﵽƽ��״̬
��ƽ��ʱCH3OH��Ũ��Ϊ0.08mol/L��
A.�٢ڢܢ�
B.�ڢ�
C.�ڢۢܢ�
D.�ڢܢ�