题目内容
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
- A.实验室制氯气中除去尾气用澄清石灰水
- B.吸收了氯气的NaOH溶液中滴入硫酸,至溶液显酸性,结果有Cl2生成
- C.铜丝在氯气中燃烧生成蓝色的烟
- D.甲烷和氯气的混合气体中发生了加成反应
B
试题分析:A.氢氧化钙溶解度小,不能用于尾气吸收,通常采用氢氧化钠溶液来处理,错误。B.在酸性情况下氯化钠、次氯酸钠发生反应得到氯气。正确。C.铜丝在氯气中燃烧生成棕黄色的烟,错误。D.甲烷和氯气的混合光照发生取代反应,错误。
考点:考查氯气的各种化学性质等知识。
试题分析:A.氢氧化钙溶解度小,不能用于尾气吸收,通常采用氢氧化钠溶液来处理,错误。B.在酸性情况下氯化钠、次氯酸钠发生反应得到氯气。正确。C.铜丝在氯气中燃烧生成棕黄色的烟,错误。D.甲烷和氯气的混合光照发生取代反应,错误。
考点:考查氯气的各种化学性质等知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某同学用下列装置制备并检验Cl2的性质.下列说法错误的是( )
A、 如图中:即使MnO2过量,盐酸也不能全部消耗 | B、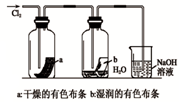 如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 | C、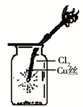 如图中:生成棕色的烟 | D、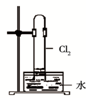 如图中:水可以充满试管 |
某同学用下列装置制备并检验Cl2的性质.下列说法正确的是( )
| A、实验室制氯气中除去尾气用澄清石灰水 | B、吸收了氯气的NaOH溶液中滴入硫酸,至溶液显酸性,结果有Cl2生成 | C、铜丝在氯气中燃烧生成蓝色的烟 | D、甲烷和氯气的混合气体中发生了加成反应 |


