��Ŀ����
��16�֣����յķϾ�п�̸ɵ�ؾ���������ɵõ��̷ۣ���Ҫ��MnO2��Mn(OH)2��Fe��NH4Cl��̿�ڵȣ������̷���ȡMnO2�IJ�����������£�
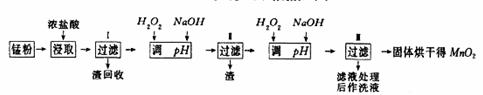
��1���ڼ��������£���Ũ�����ȡ�̷۵õ�����Mn2+��Fe3+�����ӵ���Һ��MnO2��Ũ���ᷴӦ�����ӷ���ʽ ���ô���������ȱ�� ��
��2������I�������Ļ�ѧʽ ������I�������Ļ�ѧʽ ��
��3������I����Һ�м�����H2O2������Ϊ ���ټ�NaOH��Һ����pH��3.7<pH<8.3��Ŀ���� ��
��4������II����Һ��H2O2��Һ���ټ�NaOH��Һ����pHΪ9��ʹMn2+ת����MnO2������һ������H2O2�� ��������������ԭ���������á�

| ���� | ��ʼ���� | ������ȫ |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
��2������I�������Ļ�ѧʽ ������I�������Ļ�ѧʽ ��
��3������I����Һ�м�����H2O2������Ϊ ���ټ�NaOH��Һ����pH��3.7<pH<8.3��Ŀ���� ��
��4������II����Һ��H2O2��Һ���ټ�NaOH��Һ����pHΪ9��ʹMn2+ת����MnO2������һ������H2O2�� ��������������ԭ���������á�
��1��MnO2+4H++2Cl-
��2��C��2�֣���Fe(OH)2��2��
 ��
����3����Fe2+ת��ΪFe3+��2�֣�ʹFe3+��ȫ������1�֣�����ֹMn2+ת��ΪMn(OH)2������2�֣�
��4����������2�֣�
��

��ϰ��ϵ�д�
�����Ŀ
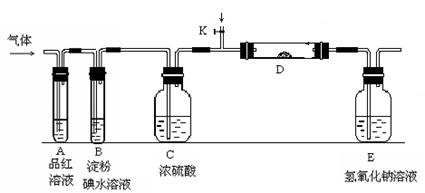
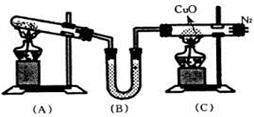
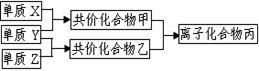
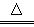
 ��3������Z��ȼ�տ��������ֲ������һ�ֲ��ﶡ�����и�ԭ������㲻ȫ��8���ӽṹ�����Ļ�ѧʽ��__________��
��3������Z��ȼ�տ��������ֲ������һ�ֲ��ﶡ�����и�ԭ������㲻ȫ��8���ӽṹ�����Ļ�ѧʽ��__________��
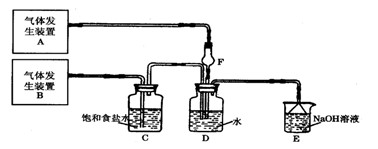
 �� �Ȼ���ϡ��Һ �� �Ȼ�������Һ �� ���軯����Һ
�� �Ȼ���ϡ��Һ �� �Ȼ�������Һ �� ���軯����Һ ��
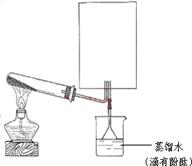
�� __��
__�� �������ô�����Һ��ϴ
�������ô�����Һ��ϴ ����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������������ˮ������
����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������������ˮ������