题目内容
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,并向a中加入少量CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是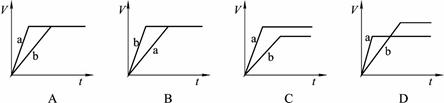
D
解析试题分析:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,则a中发生反应Zn+Cu2+=Zn2++Cu。置换出的铜与锌以及稀硫酸形成原电池,反应速率增大,反应用时少于b。但由于多消耗了锌,导致生成的氢气少也少于b,图象应为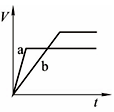 ,答案选D。
,答案选D。
考点:考查原电池的应用、外界条件对反应速率的影响以及图像分析与识别等

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强;②增加炭的量;③通入CO2;④恒压下充入N2;⑤恒容下充入N2;⑥升温
①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)  2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是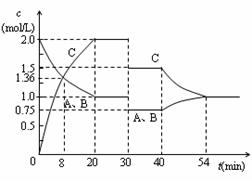
| A.30min时降低温度,40min时升高温度 |
| B.40min~54min之间反应速率v(正) < v(逆) |
| C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2 |
| D.0~8minA的平均反应速率为0.64mol/(L·min) |
下列图示与对应的叙述相符的是( )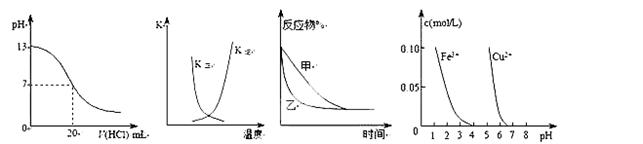
① ② ③ ④
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 |
C.图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。 |
已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:υ正<υ逆
C.若经10min后反应达到平衡,此时c(CH3OH)=0.04mol/( L·min)
D.0~10min内平均反应速率υ(CH3OH)=1.6mol/(L·min)
下列图示与对应的叙述相符的是( )。
A.图1表示可逆反应 温度 温度 的情形 的情形 |
B.图2表示压强对可逆反应 的影响,乙的压强比甲的压强大 的影响,乙的压强比甲的压强大 |
| C.图3中a、b、c三点中只有b点已经达到化学平衡状态 |
| D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线 |
 ,下列研究目的和示意图相符的是
,下列研究目的和示意图相符的是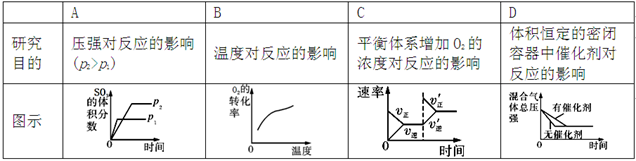
 xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是
xC(g)的生成物C在反应混合物中的百分含量w(C)和反应时间(t)的关系。下列说法与图像符合的是