题目内容
【题目】已知铍的原子半径为0.089 nm,下面是几种短周期元素的相关信息(该题中大写字母均为元素代号,不是元素符号)
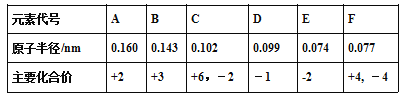
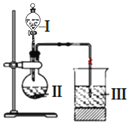
(1)C元素的简单阴离子结构示意图________,F元素在周期表中的位置____________。
(2)D的单质与水反应的离子方程式_____________,该反应生成的含氧酸的电子式________。
(3)F元素与半径最小的元素形成的最简单有机化合物的结构式___________。
(4)钠元素与E元素形成的所有化合物中,可能含有的化学键类型_______(填字母代号)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键
(5)B、C、E三种元素的简单离子半径由大到小顺序________________(填离子符号)。
(6)某同学选取稀硫酸、过量碳酸氢钠溶液和过量硅酸钠溶液,并设计了下图装置完成硫、碳、硅三种元素非金属性强弱比较的实验研究。下图中装置Ⅰ的名称_______,装置Ⅲ中反应的离子方程式_________________。
【答案】 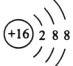 第二周期第ⅣA族
第二周期第ⅣA族 ![]() Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO 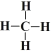 ac S2-> O2-> Al3+ 分液漏斗 SiO32- + H2O + CO2 = CO32- +H2SiO3↓
ac S2-> O2-> Al3+ 分液漏斗 SiO32- + H2O + CO2 = CO32- +H2SiO3↓
【解析】F原子中无中子,所以是H,G最高正价数与负价数相等,是且最外层电子数是次外层的二倍,所以G是C,H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径大于氧,则D为Cl;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al;F的原子径略大于E,且最高价为+4价,则F应为C元素;
(1)C为S元素,S2-离子结构示意图为 ,F为C元素,在周期表中的位置第二周期第ⅣA族;
,F为C元素,在周期表中的位置第二周期第ⅣA族;
(2)Cl2与水反应生成的HClO为弱酸,其反应的离子方程式为Cl2+H2O=H++Cl-+HClO,该反应生成的含氧酸HClO的电子式为![]() ;
;
(3)C元素与H元素形成的最简单有机化合物为CH4,其结构式为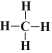 ;
;
(4)钠元素与氧元素形成的离子化合物有Na2O、Na2O2,含有的化学键类型有离子键、非极性共价键,故答案为a、c;
(5)O2-、Al3+离子结构相同,核电荷数越大离子半径越小,而S2-比前二者均多一个电子层,离子半径最大,则三种简单离子半径由大到小顺序为S2-> O2-> Al3+;
(6)依据仪器的结构,装置Ⅰ为分液漏斗;根据反应原理可知,装置Ⅲ中是硅酸钠溶液中通入CO2气体,有白色沉淀生成,发生反应的离子方程式为SiO32- + H2O + CO2 = CO32- +H2SiO3↓。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:
利用如图装置测定化学反应速率(已知:S2O32-+2H+═H2O+S↓+SO2↑)

(1)除如图装置所示的实验用品外,还需要的一种实验用品是________。
A.温度计 B.秒表 C.酒精灯
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__________。
实验二:
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(3)表中Vx=____mL,t1、t2、t3的大小关系是________。
实验三:
取5mL0.1mol/L的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液溶液2mL,发生如下反应:2Fe3++2I-==2Fe2++I2.为证明该反应达到一定可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色(AgI)沉淀;
②再取少量反应液,滴加少量CCl4,振荡,发现CCl4层显浅紫色.
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度.
(4)指导老师指出他们上述实验中①不合理,你认为其原因是___________ ;改进的方法是__________ 。
(5)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是______________________ 。

