��Ŀ����
��2011?������ģ��D��EΪ��ѧ��ѧ�����Ľ������ʣ���һ��������C��D���ܷ�����Ӧ��������ת����ϵ��ͼ��

��1��B��ͬ�������������Ϊ��
��2��д��D��H��Ӧ�����ӷ���ʽ
��3���ö��Ե缫���A��Һ��������ӦʽΪ��
��4������H��G�Ļ����Һ�к���G�������ӵ��Լ������ǣ�
a����ˮ��KSCN��Һ b������������Һ c������KMnO4��Һ
��5���ö��Ե缫���һ��Ũ�ȵ�A��Һ��ͨ��һ��ʱ�����������Һ�м���8.0gA���������ǡ�ûָ������ǰ��Ũ�Ⱥ�pH�����������ת�Ƶ��ӵ����ʵ���Ϊ

��1��B��ͬ�������������Ϊ��
����
����
��H�Ļ�ѧʽΪ��Fe2��SO4��3
Fe2��SO4��3
����2��д��D��H��Ӧ�����ӷ���ʽ
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
����3���ö��Ե缫���A��Һ��������ӦʽΪ��
4OH--4e-=2H2O+O2��
4OH--4e-=2H2O+O2��
����4������H��G�Ļ����Һ�к���G�������ӵ��Լ������ǣ�
c
c
��a����ˮ��KSCN��Һ b������������Һ c������KMnO4��Һ
��5���ö��Ե缫���һ��Ũ�ȵ�A��Һ��ͨ��һ��ʱ�����������Һ�м���8.0gA���������ǡ�ûָ������ǰ��Ũ�Ⱥ�pH�����������ת�Ƶ��ӵ����ʵ���Ϊ
0.2mol
0.2mol
mol���ռ�����״���µ��������Ϊ2.24L
2.24L
�����������A��Һ�����������ʣ���DΪ������AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2������E����B��ȼ��˵��BΪO2��CӦΪ�����ᣬ��E�������з�Ӧ������Ϊ���ᷴӦ�����������Σ�˵������Ϊ��۽�������EӦΪ
Fe����CӦΪ���ᣬ������Ϊ���ᣬ�������������������ᷴӦֻ����һ�����ʣ���GΪFeSO4��HΪFe2��SO4��3��DӦΪCu����AӦΪCuSO4�����������ʵ����ʺ���ĿҪ��ɽ����⣮
Fe����CӦΪ���ᣬ������Ϊ���ᣬ�������������������ᷴӦֻ����һ�����ʣ���GΪFeSO4��HΪFe2��SO4��3��DӦΪCu����AӦΪCuSO4�����������ʵ����ʺ���ĿҪ��ɽ����⣮
����⣺���A��Һ�����������ʣ���DΪ������AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2������E����B��ȼ��˵��BΪO2��CӦΪ�����ᣬ��E�������з�Ӧ������Ϊ���ᷴӦ�����������Σ�˵������Ϊ��۽�������EӦΪFe����CӦΪ���ᣬ������Ϊ���ᣬ�������������������ᷴӦֻ����һ�����ʣ���GΪFeSO4��HΪFe2��SO4��3��DӦΪ
Cu����AӦΪCuSO4��
��1�������Ϸ�����֪��BΪO2����Ӧ��ͬ��������Ϊ������HΪFe2��SO4��3���ʴ�Ϊ��������Fe2��SO4��3��
��2��DΪCu��HΪFe2��SO4��3�����߷�Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��
��3��AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2��������ӦʽΪ4OH--4e-=2H2O+O2����
�ʴ�Ϊ��4OH--4e-=2H2O+O2����
��4��Fe2+���л�ԭ�ԣ��������Ը��������Һ����������ԭ��Ӧ�����ø�����ؼ��飬�ʴ�Ϊ��c��
��5����������Һ�м���8.0gA���������ΪCuO��Ϊ0.1mol��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH��˵������0.1molCu��Ӧת�Ƶ���0.2mol������0.05molO2�����Ϊ0.05mol��22.4L/mol=1.12L���ʴ�Ϊ��0.2mol��1.12L��
Cu����AӦΪCuSO4��
��1�������Ϸ�����֪��BΪO2����Ӧ��ͬ��������Ϊ������HΪFe2��SO4��3���ʴ�Ϊ��������Fe2��SO4��3��
��2��DΪCu��HΪFe2��SO4��3�����߷�Ӧ�����ӷ���ʽΪ2Fe3++Cu=2Fe2++Cu2+���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��
��3��AӦΪ�����ý����ĺ������Σ����ʱ�����������ɽ�����������Ӧ����O2��������ӦʽΪ4OH--4e-=2H2O+O2����
�ʴ�Ϊ��4OH--4e-=2H2O+O2����
��4��Fe2+���л�ԭ�ԣ��������Ը��������Һ����������ԭ��Ӧ�����ø�����ؼ��飬�ʴ�Ϊ��c��
��5����������Һ�м���8.0gA���������ΪCuO��Ϊ0.1mol��ǡ�ûָ������ǰ��Ũ�Ⱥ�pH��˵������0.1molCu��Ӧת�Ƶ���0.2mol������0.05molO2�����Ϊ0.05mol��22.4L/mol=1.12L���ʴ�Ϊ��0.2mol��1.12L��
���������⿼��������ƶϣ���Ŀ�ѶȲ�����ע����յ����ص㣬����ӵ��ĽǶ������ƶϣ�ע��������Ԫ�ػ������֪ʶ���״���Ϊ��5����ע��������Һ�ı仯��

��ϰ��ϵ�д�
�����Ŀ
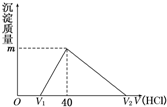 ��2011?������ģ����һ�����������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20mL OH-Ũ��Ϊ1mol/L����Һ��Ȼ����1mol/L������ζ���������������������������ϵ��ͼ��ʾ��������ѡ����ȷ���ǣ�������
��2011?������ģ����һ�����������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20mL OH-Ũ��Ϊ1mol/L����Һ��Ȼ����1mol/L������ζ���������������������������ϵ��ͼ��ʾ��������ѡ����ȷ���ǣ�������