题目内容
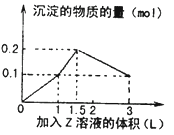
【题目】1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.lmol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )
A.氯化铝、氯化铁、氢氧化钠 B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸 D.偏铝酸钠、氯化钡、硫酸
【答案】C
【解析】
试题分析 :A.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3 + + 3OH- = Al(OH)3↓,Fe3 + + 3OH- = Fe(OH)3↓,n(Al3 + ) :n(OH-) = 1 :3,n(Fe3 + ) :n(OH-) = 1 :3,继续滴加Al(OH)3 + OH- = AlO2- + 2H2O,n(Al(OH)3) :n(OH-) = 1 :1,不符合图象的数值变化,故A错误;B.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2 + + 2OH- = Mg(OH)2↓,Al3 + + 3OH- = Al(OH)3↓,n(Mg2 + ) :n(OH-) = 1 :2,n(Al3 + ) :n(OH-) = 1 :3,继续滴加Al(OH)3 + OH- = AlO2- + 2H2O,n(Al(OH)3) :n(OH-) = 1 :1,不符合图象的数值变化,故B错误;C.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,开始滴入硫酸时OH- + H + = H2O,Ba2 + + SO42- = BaSO4↓,H + + AlO2- + H2O = Al(OH)3↓,图中第一段直线 :氢氧化钡的OH-和硫酸里的H + 1 :1中和,同时Ba2 + 和SO42-1 :1反应生成硫酸钡沉淀,Ba2 + + 2OH- + 2H + + SO42- = BaSO4↓ + 2H2O;图中第二段直线氢氧化钡消耗完,硫酸继续滴加,氢离子开始和偏铝酸根离子反应H + + AlO2- + H2O = Al(OH)3↓,硫酸的消耗量(硫酸消耗量是氢离子消耗量的一半)和沉淀的生成量是1 :2;图中第三段直线 :硫酸进一步过量,开始消耗沉淀,Al(OH)3 + 3H + = Al3 + + 3H2O硫酸和沉淀消耗量应为1.5 :1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化,故C正确;D.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时Ba2 + + SO42- = BaSO4↓,H + + AlO2- + H2O = Al(OH)3↓,Al(OH)3 + 3H + = Al3 + + 3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故D错误;故选C。