题目内容
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() (正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
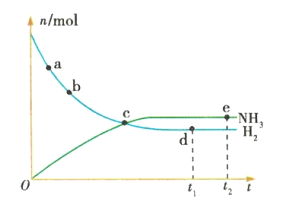
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
【答案】B
【解析】
A.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,所以正、逆反应速率不相等,故A错误;
B.从a点到b点,氢气的物质的量在逐渐减少,则其物质的量浓度在逐渐减少,所以正反应的反应速率在逐渐减小,即a点的正反应速率比b点的大,故B正确;
C.d点和 e点都处于平衡状态,n(N2)不变,即d点和e点处n(N2)相等,故C错误;
D.在t2时刻,该反应处于化学平衡状态,所以正、逆反应速率相等,故D错误;
故选B。

【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
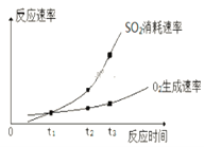
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
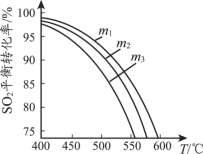
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。