题目内容
【题目】(1)2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1 则氢气的燃烧热为 。
(2)C(石墨)![]() C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
(3)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,图中的括号内应填入(“+”或“-”)。
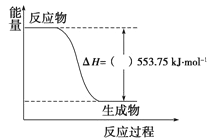
②写出表示丙烷燃烧热的热化学方程式: 。
(4)试运用盖斯定律回答下列问题:
已知:C2H5OH(g)=C2H5OH(l);△H1=-![]() kJ/mol,
kJ/mol,
H2O(g)=H2O(l);△H2=-![]() kJ/mol,
kJ/mol,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-![]() kJ/mol。
kJ/mol。
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 KJ
【答案】(12分)
(1)242kJ·mol-1 (2分)
(2)大于 (2分)
(3)①-(1分)②C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0 kJ/mol(3分)
(4)3Q2+Q3-Q1(4分)
【解析】
试题分析:
(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的能量。根据热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1,则氢气的燃烧热为242kJ·mol-1。
(2)C(石墨)![]() C(金刚石)△H>0,石墨生成金刚石是吸热的,则说明石墨的能力比金刚石的能量低,能量越低越稳定。则稳定性:石墨大于金刚石。
C(金刚石)△H>0,石墨生成金刚石是吸热的,则说明石墨的能力比金刚石的能量低,能量越低越稳定。则稳定性:石墨大于金刚石。
(3)①丙烷完全燃烧生成CO2和1 mol H2O(l)的过程放热,ΔH为“-”。②燃烧热是将1 mol物质完全燃烧生成稳定氧化物时放出的热量,所以表示丙烷燃烧热的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2215.0 kJ/mol。
(4)①由②×3+③-①可得C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH4=-(3Q2+Q3-Q1) kJ/mol,所以使46 g液态无水酒精完全燃烧,并恢复到室温,整个过程中放出的热量为(3Q2+Q3-Q1) kJ。
