题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
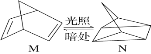
(1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ·mol-1, 则M与N较稳定的是_________。
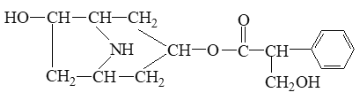
(2)已知CH3OH(l)的燃烧热为726.5 kJ·mol-1,CH3OH(l) +1/2 O2(g)===CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时放出145 kJ热量,写出该反应的热化学方程式:_____________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 __________ 。
(5)已知拆开1 mol H-H键、1 mol N-H键、1 mol N≡N 键分别需要的能量是a kJ、b kJ、c kJ,则N2与H2反应生成NH3的热化学方程式为 _________________________________ 。
(6)通过以下反应可获得新型能源二甲醚(CH3OCH3)。
①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
则反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=__________________________________ 。(用含a,b,c,d的式子表示)
【答案】M < 2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH =-290 kJ·mol-1 98 kJ N2(g)+3H2(g)===2NH3(g) ΔH = (3a+c-6b) kJ·mol-1 (2b+2c+d) kJ·mol-1
【解析】
根据键能计算反应热,根据热化学方程式的书写规则书写热方程式,并运用盖斯定律计算反应热。
(1)ΔH![]() ,为吸热反应,能量越低越稳定,则M与N相比较稳定的是M;
,为吸热反应,能量越低越稳定,则M与N相比较稳定的是M;
(2)H2O(g)![]() H2O(l)过程中放热,则a<726.5;
H2O(l)过程中放热,则a<726.5;
(3)根据热化学方程式的书写规则,此热化学方程式为:2Cl2(g)+2H2O(g)+C(s)==4HCl(g)+CO2(g) ΔH =-290 kJ·mol-1;
(4)由热化学方程式4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1得,4mol铝反应放出1176 kJ热量,反应中铝化合价由0升高到+3,失去12mol电子,所以每转移1 mol电子放出的热量为1176 kJ/12=98 kJ;
(5)在反应N2+3H22NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:(3a+c)kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×bkJ,该反应吸收的热量为:(3a+c-6b) kJ;
故答案为:N2(g)+3H2(g)===2NH3(g) ΔH = (3a+c-6b) kJ·mol-1;
(6)结合盖斯定律,找出反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)可以由2×②+2×③+④得到,则ΔH=(2b+2c+d) kJ·mol-1。

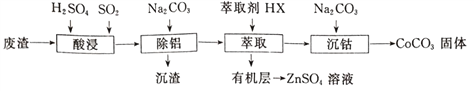
【题目】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________。
(2)“除铝”过程中需要调节溶液pH的范围为______________,形成沉渣时发生反应的离子方程式为_____________________。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为____________________。