题目内容
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示. 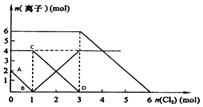
已知:
2Fe2++Br2═2Fe3++2Br﹣
2Fe3++2I﹣═2Fe2++I2
(1)Fe2+、I﹣、Br﹣的还原性由强到弱排列顺序为 .
(2)C→D代表离子浓度的变化.
(3)当通入1mol Cl2时,溶液中已发生的离子反应可表示为: .
(4)原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=
(5)通入2mol Cl2时,溶液中已发生的离子反应可表示为: .
【答案】
(1)I﹣>Fe2+>Br﹣
(2)Fe2+
(3)Cl2+2I﹣=2Cl﹣+I2
(4)2:1:3
(5)2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣
【解析】解:(1)反应2Fe2++Br2=2Fe3++2Br﹣中,还原剂Fe2+的还原性强于还原产物Br﹣ , 所以还原性:Fe2+>Br﹣ , 反应2Fe3++2I﹣=2Fe2++I2中,还原剂I﹣的还原性强于还原产物Fe2+ , 所以还原性:I﹣>Fe2+ , 所以还原性I﹣>Fe2+>Br﹣;所以答案是:I﹣>Fe2+>Br﹣;(2)A→B代表碘离子,而C→D代表亚铁离子浓度的变化,所以答案是:Fe2+;(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;所以当通入1mol Cl2时,溶液中已发生的离子反应可表示为:Cl2+2I﹣=2Cl﹣+I2 , 所以答案是:Cl2+2I﹣=2Cl﹣+I2;(4)碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I﹣):n(Br﹣)=2:1:3;
所以答案是:2:1:3;(5)当通入2molCl2时,2mol的I﹣消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣;
所以答案是:2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣ .


