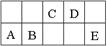
题目内容
下列比较中,正确的是
| A.CH4与SiH4的稳定性:CH4>SiH4 |
| B.HClO与H2SO4的酸性:HClO >H2SO4 |
| C.1molHCl(g)的能量比1molH2(g)和1molCl2(g)的能量和高 |
| D.Cl与S的原子半径:Cl >S |
A
解析

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
对发现元素周期律贡献最大的化学家是 ( )
| A.牛顿 | B.道尔顿 | C.阿伏加德罗 | D.门捷列夫 |
下列化学用语表示正确的是
| A.原子核中有6个中子的硼原子:6 B | B.HCl的电子式: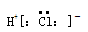 |
C.K+结构示意图: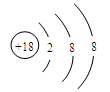 | D.HClO的结构式:H—O—Cl |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
| A.工业上电解YW饱和溶液冶炼金属Y |
| B.气态氢化物的稳定性:W > X |
| C.简单离子半径的大小顺序:r(Y+)>r(X—) |
| D.Y、W的最高价氧化物的水化物均能溶解金属Z |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
| A.N5+ 离子中含有36个电子 | B.H2与H3属于同素异形体 |
| C.C60的摩尔质量为720 | D.O2与O4属于同位素 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
| R | T | |
| X | Y | Z |
A.X位于元素周期表中第三周期第VIA族
B.Z元素的气态氢化物为极性分子
C.Y元素最高价氧化物对应水化物为强酸
D.五种元素中原子半径最大的是R
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如下图所示转化关系;其中乙和丙均为10电子气体分子,且二者相遇生成弱碱。下列说法正确的是( )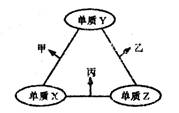
| A.X元素位于第ⅣA族 |
| B.热稳定性:乙<丙 |
| C.甲和丙可能发生氧化还原反应 |
| D.分子乙中各原子均达8电子稳定结构 |
下列说法正确的是 ( )
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.离子化合物中不可能存在共价键 |
| D.金属元素与非金属元素形成的化合物一定是离子化合物 |