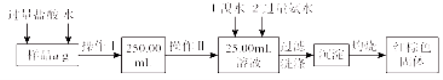
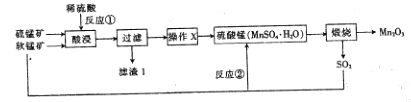
题目内容
【题目】目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等。
乙炔法:![]()
丙烯氨氧化法:![]()
(1)下列说法正确的是 (不定项选择):
a.NH4+空间构型呈正四面体
b.CH2=CHCN分子中只有碳、氢原子位于同一平面
c.C2H2、HCN分子中所有原子均位于同一直线
d.NH3极易溶于H2O,是因为它们都是极性分子
(2)与NH3互为等电子体的阳离子为 (写化学式)。
(3)1mol丙烯腈分子中含有![]() 键的数目为 。
键的数目为 。
(4)铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成。
①该反应的化学方程式为 。
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为 。
【答案】(1)ac (2)H3O+ (3)6mol [或6×6.02×1023、或3.6×1024、或6NA]
(4)(5分)2Cu + 4HCl(浓) =2H [CuCl2]+H2↑
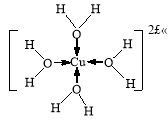 (或
(或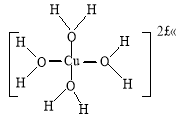 )
)
【解析】
试题分析:(1)a.NH4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,所以空间构型呈正四面体,正确;b.CH2=CH-C≡N分子相当于一个碳碳双键和一个碳氮叁键通过一个碳碳单键相连,所以所有原子都处在同一平面上,错误;c.C2H2、HCN分子都含有一个叁键,所以都为sp杂化,则所有原子均位于同一直线,正确;d.因为NH3能与H2O分子间形成氢键,所以NH3极易溶于H2O,错误,答案选ac;
(2)NH3含有4个原子,价电子总数为8个电子,则对应的等电子体有H3O+;
(3)因为每个单键、双键、叁键都含有1个δ键,所以1mol丙烯腈分子中含有σ键的数目为6mol;
(4)①铜能与浓盐酸缓慢发生置换反应产生氢气,有配合物H[CuCl2]生成,因此该反应的方程式为2Cu + 4HCl(浓) =2H [CuCl2]+H2↑;
②由于水中的原子含有孤对电子,铜原子含有空轨道,因此铜离子能与水形成配位键,则[Cu(H2O)4]2+的结构可用示意图表示为
 。
。