题目内容
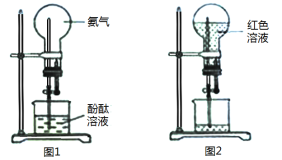
【题目】实验室制备并收集干燥、纯净氯气的装置如图所示:

(1)写出实验室制备Cl2的化学方程式:___。
(2)写出指定试剂的名称,C__,D__。
(3)C的作用是__,D的作用是__,F的作用是___。
(4)检验氯气是否收集满的操作:___。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是___,若反应产生0.5mol Cl2,则消耗的氧化剂的物质的量为___mol,反应转移的电子数是___。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 除去氯气中混有的氯化氢气体 干燥氯气 吸收氯气,防止污染空气 用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝,说明氯气已收集满 还原性和酸性 0.2mol NA
MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 除去氯气中混有的氯化氢气体 干燥氯气 吸收氯气,防止污染空气 用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝,说明氯气已收集满 还原性和酸性 0.2mol NA
【解析】
(1)实验室用浓盐酸和二氧化锰共热来制取氯气;
(2)(3)一套完整的气体制备装置需要发生装置、除杂装置、收集装置和尾气处理装置。
(4)氯气有强氧化性,可以此来检验氯气是否已满;
(5)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中氯元素化合价升高被氧化,锰元素化合价降低被还原;
(1)实验室用浓盐酸和二氧化锰共热来制取氯气,
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气中杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥,
故答案为:饱和食盐水;浓硫酸;
(3)氯气中杂质有挥发出来的氯化氢和水蒸气,C装饱和氯化钠溶液除去氯化氢,D中装浓硫酸进行干燥,氯气有毒尾气需要处理,F中可用氢氧化钠溶液处理尾气,
故答案为:除去氯气中混有的氯化氢气体;干燥氯气;吸收氯气,防止污染空气;
(4)氯气有强氧化性,可使湿润的淀粉碘化钾试纸变蓝,
故答案为:用湿润的淀粉碘化钾试纸靠近集气瓶口,若试纸变蓝,说明氯气已收集满;
(5)反应中氯化氢中部分氯元素化合价降低;部分氯元素做盐中的阴离子,体现了还原性和酸性;反应中氯元素由-1价到0价,锰元素由+7到+2价,降低5价,故生成1个氯气分子转移两个电子,消耗2/5个氧化剂,所以产生0.5mol Cl2,则消耗的氧化剂的物质的量为0.2mol,反应转移的电子数是NA,
故答案为:还原性和酸性;0.2mol;NA。

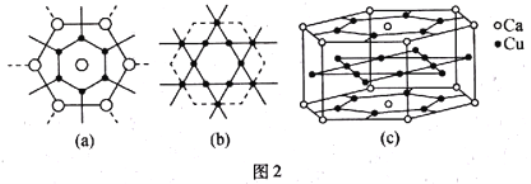
【题目】元素X、Y、Z和W在周期表中的位置如图所示,其中X、Y、Z均为短周期元素,且X、Y、W原子的最外层电子数之和为13。下列说法不正确的是( )
X | Y | ||
Z | |||
W |
A. 原子半径:![]()
B. W的最高价氧化物对应的水化物可能为强碱
C. 上述四种元素可形成化合物![]()
D. 一定条件下,Z单质与X的氢化物及Y的氢化物均能反应