题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用。
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_______
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质)。写出该电池的负极反应式:_______。
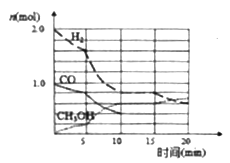
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。
CH3OH(g)。某温度下在容积为VL的密闭容器中进行反应,其相关数据戔右图;反应开始至平衡时,用H2表示化学反应速率为________。该温度下CO的平衡转化率为_________。
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为_________(填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正__________v逆。(填“>”、“<”或“=”)
【答案】 4H2(g ) + 2NO2( g)=N2(g ) + 4H2O(g) ΔH=- 1100.2KJ/mol CO+CO32-—2e- =2CO2 0 .12 /Vmol ( L·min ) 60% a b e b >
【解析】Ⅰ、已知:①H2的热值为142.9kJ/g 则 H2(g)+ ![]() O2(g)=H2O(l) ΔH1=-285.8kJ/mol;②N2(g)+2O2(g)=2NO2(g) ΔH2=+133kJ/mol;③H2O(g)=H2O(l) ΔH3=-44kJ/mol;根据盖斯定律由①×4-②-③×4可得4H2(g)+2NO2(g) =2H2O(g)+N2(g),ΔH=(-285.8kJ/mol)×4-(+133kJ/mol)-(-44kJ/mol)×4=- 1100.2kJ/mol,故此反应的热化学方程式为 4H2(g ) + 2NO2( g)=N2(g ) + 4H2O(g) ΔH=- 1100.2kJ/mol ;
O2(g)=H2O(l) ΔH1=-285.8kJ/mol;②N2(g)+2O2(g)=2NO2(g) ΔH2=+133kJ/mol;③H2O(g)=H2O(l) ΔH3=-44kJ/mol;根据盖斯定律由①×4-②-③×4可得4H2(g)+2NO2(g) =2H2O(g)+N2(g),ΔH=(-285.8kJ/mol)×4-(+133kJ/mol)-(-44kJ/mol)×4=- 1100.2kJ/mol,故此反应的热化学方程式为 4H2(g ) + 2NO2( g)=N2(g ) + 4H2O(g) ΔH=- 1100.2kJ/mol ;
Ⅱ(1)CO在负极反应生成反应,与负极周围的CO32-结合生成CO2,反应式为CO+CO32-—2e- =2CO2;
(2)反应开始至平衡时需要时间为10min,H2的变化物质的量为2.0mol-0.8mol=1.2mol,则用H2表示化学反应速率为 =0 .12 /Vmol ( L·min ) ;至平衡时CO的变化物质的量为1.0mol-0.4mol=0.6mol,该温度下CO的平衡转化率为
=0 .12 /Vmol ( L·min ) ;至平衡时CO的变化物质的量为1.0mol-0.4mol=0.6mol,该温度下CO的平衡转化率为![]() ×100%=60%;
×100%=60%;
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g).
CH3OH(g)+H2O(g).
①a.混合气体的总质量始终不变,气体的物质的量总和在变化,则混合气体的平均相对分子质量保持不变时说明气体的物质的量总和不在变化,说明是平衡状态,故a正确;b.CO2和H2的体积分数保持不变,CO2和H2的量不再变化,说明是平衡状态,故b正确;c.CO2和H2的变化量和起始量始终是1:3,则CO2和H2的转化率始终相等,不能说明是平衡状态,故c错误;d.混合气体的体积和质量始终不变,密度保持不变,不能说明是平衡状态,故d错误;e.1molCO2生成说明同时生成3molH-H键,此时3molH-H键断裂,说明是平衡状态,故e正确;,故答案为abe;
②设平衡时二氧化碳转化了xmol, CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),开始1(mol):1 3 0 0变化1(mol):x3x xx平衡1(mol):1-x 3-3x xx开始2 a3a b b则由题意可知:
CH3OH(g)+H2O(g),开始1(mol):1 3 0 0变化1(mol):x3x xx平衡1(mol):1-x 3-3x xx开始2 a3a b b则由题意可知: ![]() =0.6,解得x=0.8,根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+b=1,要使反应始终向逆向进行,则b>x,故b的范围为1≥b>0.8,符合题意的b可能为0.9,答案为b。此温度下的平衡常数K=
=0.6,解得x=0.8,根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+b=1,要使反应始终向逆向进行,则b>x,故b的范围为1≥b>0.8,符合题意的b可能为0.9,答案为b。此温度下的平衡常数K=![]() =14.8;若保持温度不变,起始加入0.5molCO2、0.5molH
=14.8;若保持温度不变,起始加入0.5molCO2、0.5molH![]() =4<K,说明此时反应正向进行,即v正>v逆。
=4<K,说明此时反应正向进行,即v正>v逆。

【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成。向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是__________。(结合有关平衡方程式简要说明)
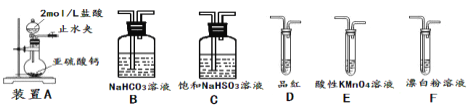
②欲验证酸性:H2SO3>HClO,选用下面的装置,其连接顺序为:
A![]() ________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
________(按气流方向用大写字母表示即可)。能证明H2SO3的酸性强于HClO的实验现象为___。
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
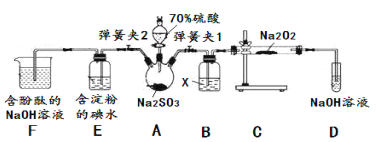
操作步骤 | 实验现象 | 解释原因 |
关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①____ |
若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2=2Na2SO3+O2 | |
关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中。 | E中②__________ | E中反应的离子方程式③________ |
F中④__________ | F中反应为2OH-+SO2=SO32-+H2O |
【题目】二氯化碳利用具有十分重要的意义,科学家有以下几个设想。
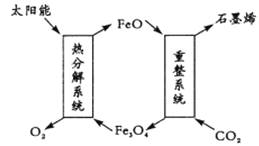
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和 __________;
②重整系统发生反应的化学方程式为______________________________。
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
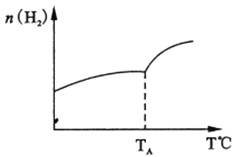
① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将_____________(填“增大”、“ 减小”或“不变”);
②△H________0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 ________ H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq) ![]() NH4+ (aq) +OH-(aq) △H1=a kJmol-1
NH4+ (aq) +OH-(aq) △H1=a kJmol-1
CO2 (g) + H2O(l)![]() H2CO3 (aq) △H2=bkJmol-1
H2CO3 (aq) △H2=bkJmol-1
H2CO3(aq) + OH-(aq)![]() HCO3-(aq) + H2O(l) △H3=ckJmol-1
HCO3-(aq) + H2O(l) △H3=ckJmol-1
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为_____________________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5mol L-1 |
Ka1(H2CO3) | 4×10-7mol L-1 |
Ka2(H2CO3) | 4×10-11mol L-1 |
则反应NH4++HCO3-+H2O![]() NH3 H2O+ H2CO3的平衡常数k=___________。
NH3 H2O+ H2CO3的平衡常数k=___________。