题目内容
【题目】铜元素的化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态外围电子排布式为_______________。
② S、O、N三种元素的第一电离能由大到小为_____________。
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________。
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:

① 配合物A中N原子的轨道杂化类型为__________。
② 1 mol配合物A含有σ键的数目为_____________。
(3)CuFeS2的晶胞如图1所示,CuFeS2的晶胞中每个Cu原子与__个S原子相连

【答案】3d9N>O>SCuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高sp320mol4
【解析】试题分析:通过对指定物质的探究,考查考生对原子核外电子排布、外围电子排布、第一电离能、晶格能、杂化、共价键的类型和数目、晶体结构等知识的掌握程度。
解析:(1)① CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu为29号元素,其基态电子排布式为1s22s22p63s23p63d104s1,转变成Cu2+时,首先失去最外层能量最高的4s电子,然后失去能量稍低的3d电子,所以Cu2+基态电子排布式为1s22s22p63s23p63d9,基态外围电子排布式为3d9。答案:3d9。
② S和O位于同一主族,S在O的下方,所以O的第一电离能更大;N和O位于同一周期,N位于O的左侧,但是由于N的电子排布为1s22s22p3,2p为半充满状态,所以N的第一电离能更大。答案:N>O>S。
③ CuSO4和Cu(NO3)2均为离子晶体,熔点的大小取决于晶体的晶格能,组成中,由于SO42-带有2个单位负电荷,而NO3-只有一个单位负电荷,所以CuSO4晶体晶格能更大,熔点更高。答案:CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高。
(2)①配合物A中N原子连接1个H原子和2个C原子,无孤对电子,因此其杂化方式为sp3。答案:sp3。
②两个五元环各5个σ键,2个N原子连接的另外4个H原子共有4个σ键,环上下2个C原子各连接2个H原子共4个σ键,环连接的O原子含有1个σ键,所以σ键总数为5+5+4+4+2=20。答案:20。
(3)以图中第二层Cu原子观察,连接的S原子为4个。答案:4。

 暑假作业安徽少年儿童出版社系列答案
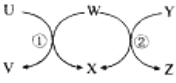
暑假作业安徽少年儿童出版社系列答案【题目】图中UZ六种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )
序号 | U | W | Y | X |
|
① | Na | H2O | Na2O2 | NaOH | |
② | Fe | H2O | C | H2 | |
③ | HBr | Cl2 | CH4 | HCl | |
④ | CuCl2(aq) | Al | HCl(aq) | AlCl3(aq) |
A. ②④ B. ②③ C. ①②④ D. ①②③④