题目内容
下列反应离子方程式正确的是( )
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO42-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成碳酸钙和水;
B.发生氧化还原反应,遵循电子、电荷守恒及原子守恒;
C.反应生成氢氧化铝和氯化铵;
D.不符合离子的配比.
B.发生氧化还原反应,遵循电子、电荷守恒及原子守恒;
C.反应生成氢氧化铝和氯化铵;
D.不符合离子的配比.
解答:
解:A.过量石灰水与碳酸氢钙反应的离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.FeSO4酸性溶液暴露在空气中的离子反应为4Fe2++O2+4H+═4Fe3++2H2O,故B正确;
C.向氯化铝溶液中滴加过量氨水的离子反应为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.H2SO4与Ba(OH)2溶液反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选B.
B.FeSO4酸性溶液暴露在空气中的离子反应为4Fe2++O2+4H+═4Fe3++2H2O,故B正确;
C.向氯化铝溶液中滴加过量氨水的离子反应为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D.H2SO4与Ba(OH)2溶液反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故D错误;
故选B.
点评:本题考查离子反应书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列不属于天然高分子化合物的是( )
| A、淀粉 | B、氨基酸 |
| C、纤维素 | D、蛋白质 |
用电子式表示粒子,错误的是( )
| A、Na+ |
B、 |
C、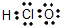 |
D、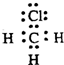 |
A、B、C、D、E是原子序数依次增大的五种短周期元素,A、E的原子核外最外层电子数之和为13,D原子的最外层电子数是C原子最外层电子数或电子层数的2倍,B与C同周期但不相邻.下列说法正确的是( )
| A、B与D形成的化合物为共价化合物 |
| B、E的单质能从水中置换出O2 |
| C、C的氧化物可溶于B、D、E的最高价氧化物对应的水化物溶液中 |
| D、五种元素的最高正化合价都等于其所在的族序数 |
下列反应中葡萄糖被还原的是( )
| A、葡萄糖在人体内变成CO2和H2O |
| B、葡萄糖燃烧 |
| C、葡萄糖发生银镜反应 |
| D、葡萄糖变成己六醇 |
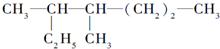 的名称是
的名称是 分子式为
分子式为
 、④HCHO.其中碳原子采取sp2杂化的分子有
、④HCHO.其中碳原子采取sp2杂化的分子有