题目内容
盐酸滴入Na2CO3溶液中,有下列反应:
Na2CO3+HCl====NaHCO3+NaCl ①
NaHCO3+HCl====NaCl+H2O+CO2↑ ②
并将含有HCl 0.2 mol的稀盐酸,加入含Na2CO3 0.14 mol的溶液中,经充分反应后,溶液中各物质的量是( )
Na2CO3 ? HCl NaCl ?NaHCO3
Na2CO3+HCl====NaHCO3+NaCl ①
NaHCO3+HCl====NaCl+H2O+CO2↑ ②
并将含有HCl 0.2 mol的稀盐酸,加入含Na2CO3 0.14 mol的溶液中,经充分反应后,溶液中各物质的量是( )
Na2CO3 ? HCl NaCl ?NaHCO3
| A.0 mol 0 mol 0.2 mol 0.08 mol |
| B.0.4 mol 0 mol 0.2 mol 0 mol |
| C.0 mol 0.06 mol 0.14 mol 0.14 mol |
| D.0 mol 0 mol 0.06 mol 0.08 mol |
A
盐酸逐滴滴入Na2CO3溶液中后,首先发生反应①,待全部Na2CO3转化为NaHCO3后,再进行反应②,0.14 mol Na2CO3转化成NaHCO3消耗HCl 0.14 mol,剩余HCl 0.06 mol,生成NaHCO3 0.14 mol,剩余的HCl再与NaHCO3反应消耗NaHCO3 0.06 mol,剩余NaHCO3 0.14 mol-0.06 mol="0.08" mol,共生成NaCl 0.2 mol(可从Cl元素守恒讨论)。

练习册系列答案
相关题目
 的物质的量浓度分别为:0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则所取溶液的体积比是(忽略溶液混合带来总体积的变化( )
的物质的量浓度分别为:0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则所取溶液的体积比是(忽略溶液混合带来总体积的变化( )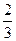 。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。
。假设溶质不外泄,则所得溶液的物质的量浓度为_________________________。