题目内容
工业上用重晶石(主要成分BaSO4)为原料制备BaCl2和锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:

请根据上述流程回答下列问题:
(1) 假设煅烧时还原产物只有BaS,则反应的化学方程式为______________________。
(2) 设备2中所用的洗涤剂是碱液,则Y的化学式为________。
(3) 溶解固体所用的酸为________(填化学式),生成的气体用过量NaOH溶液吸收,其反应的离子方程式为_______________________________________________。
(4) 处理过程(b)的具体步骤为____________________。
(5) 锌钡白的成分是____________(填化学式)。
(1) BaSO4+4C![]() 4CO↑+BaS 或BaSO4+2C
4CO↑+BaS 或BaSO4+2C![]() 2CO2 ↑+BaS
2CO2 ↑+BaS
(2) CO
(3) HCl 2OH-+H2S===S2-+H2O
(4) 过滤、洗涤、干燥
(5) BaSO4和ZnS
解析:(1)BaSO4与C反应,氧化剂是BaSO4,还原产物是BaS,还原剂是C,高温下的氧化产物是CO或CO2。
(2) 废气中的酸性气体CO2、SO2和NaOH溶液都反应,反应方程式分别是CO2+2NaOH===Na2CO3+H2O,SO2+2NaOH===Na2SO3+H2O,最后排出的气体只有CO气体。
(3) 固体的成分是BaS,用酸(盐酸,用硫酸后续得不到BaCl2)溶解,BaS+2H+===Ba2++H2S↑, H2S是酸性气体,可用碱吸收。
(4) ZnSO4与BaS反应方程式是BaS+ZnSO4===BaSO4↓+ZnS↓,分离沉淀的方法是过滤、洗涤、干燥。

 阅读快车系列答案
阅读快车系列答案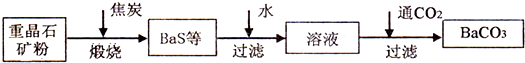

 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)