题目内容
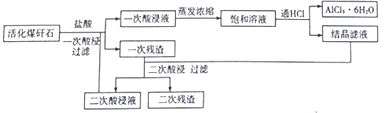
【题目】某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
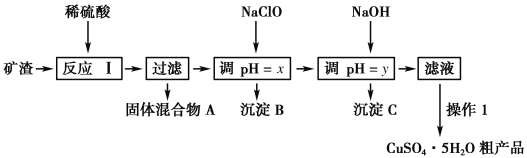
已知:①Cu2O+2H+===Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
(1)为了加快反应Ⅰ的速率,可以采取的措施是____________ (写两条)。
(2)固体混合物A中的成分是________。
(3)反应Ⅰ完成后,铁元素的存在形式为________(填离子符号);写出生成该离子的离子方程式____________。
(4)操作1主要包括:蒸发浓缩、冷却结晶、________。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是______________。
(5)用NaCl0调pH可以生成沉淀B,利用题中所给信息分析沉淀B为_______,该反应的离子方程式为______________.
【答案】适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等;SiO2、CuFe2+2Fe3++Cu=Cu2++2Fe2+过滤;冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;2Fe2++ClO-+5H2O=2Fe(OH)3+Cl-+4H+
【解析】
(1)由于矿渣为固体,所以为了加快反应Ⅰ的速率,可以采取的措施是将固体粉碎;也可以适当升高反应的温度;或增大反应物H2SO4的浓度等措施;(2)SiO2是酸性氧化物,不能与酸发生反应,Cu2O在酸性条件下发生自身氧化还原反应,反应的离子方程式为:Cu2O+2H+=Cu+Cu2++H2O;溶液中发生了反应:2Fe3++Cu=Cu2++2Fe2+,溶液中铁元素的存在形式为Fe2+;洗涤CuSO45H2O粗产品不能用大量水洗,而用冰水洗涤,原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大.若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;用NaClO调节pH时,反应生成Fe(OH)3沉淀和具有漂白作用的HClO。
(1)由于矿渣为固体,所以为了加快反应I的速率,可以采取的措施是将固体粉碎,也可以适当升高反应的温度,或增大反应物H2SO4的浓度等措施。(2)SiO2是酸性氧化物,不能与酸发生反应;其它金属氧化物Cu2O、Al2O3、Fe2O3与硫酸发生反应:Cu2O+H2SO4=Cu+
CuSO4+H2O、Al2O3+3H2SO4=Al2(SO4)3+3H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Cu=CuSO4+ 2FeSO4,因此发生反应I后过滤出的固体混合物A中的成分是SiO2和Cu。(3)因为在矿渣中Fe元素的化合价为+3价,先与酸发生复分解反应得到Fe2(SO4)3, Fe2(SO4)3与Cu发生反应:2Fe3++Cu=Cu2++2Fe2+,铁元素的存在形式为Fe2+。(4)从硫酸铜溶液中制取硫酸铜晶体的操作1主要包括:蒸发浓缩、冷却结晶、过滤;洗涤五水硫酸铜晶体粗产品不能用大量水洗,而用冰水洗涤的原因是CuSO4溶液溶解于水,而且温度越高,溶解度越大,若用冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失;(5)NaClO具有氧化性,Fe2+具有还原性,用NaClO调节pH时,反应生成Fe(OH)3沉淀和具有漂白作用的HClO,反应的离子方程式为2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案