题目内容
11.下列电离方程式中,不正确的是( )| A. | H2O+H2O?H3O++OH- | B. | NH3•H2O═NH4++OH- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | Na2CO3═2Na++CO32- |
分析 化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开.弱电解质的电离用“?”,强电解质的电离用“═”,以此来解答.
解答 解:A.H2O是弱电解质,部分电离,用可逆号,电离方程式为H2O+H2O?H3O++OH-,故A正确;
B.氨水是弱电解质,部分电离,用可逆号,电离电离方程式为:NH3•H2O?NH4++OH-,故B错误;
C.CH3COOH是弱电解质,部分电离,用可逆号,电离电离方程式为:CH3COOH?CH3COO-+H+,故C正确;
D.Na2CO3是强电解质,完全电离,电离方程式为:Na2CO3═2Na++CO32-,故D正确;
故选B.
点评 本题考查电离方程式的书写,明确书写方法及弱电解质的电离书写是解答的关键,题目难度不大.

练习册系列答案
相关题目
1.已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子表示H2SO4.一般而言,该式中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
| A. | HClO3 | B. | H2SeO3 | C. | H3BO3 | D. | HMnO4 |
19.下列说法不正确的是( )
| A. | 已知冰的熔化热为 6.0kJ•mol-1,冰中氢键键能为 20 kJ•mol-1,若熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 在一定条件下,某可逆反应的△H=+100 kJ•mol-1,则该反应正反应活化能比逆反应活化能大100 kJ•mol-1 | |
| C. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则 1molCH4 发生反应CH4(g)+2O2(g)═CO2 (g)+2H2O (g) 放出的热量小于 890.3 kJ•mol-1 | |
| D. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3 (g),放出量热 19.3 kJ,其热化学方程式可表示为: N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 |
6.下列物质属于电解质的是( )
| A. | 氯化钠 | B. | 铁 | C. | 盐酸 | D. | 葡萄糖 |
16.下列离子方程式不正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+═Fe 2++H2↑ | |
| B. | 氯气通入水中:Cl2+2H2O?H++Cl-+HClO | |
| C. | 澄清石灰水中通入少量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
20.相同质量的下列各烃,完全燃烧后生成CO2最多的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙烷 |
1.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
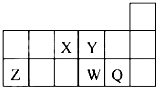

| A. | 元素X与元素Z的正化合价之和的数值等于8 | |
| B. | 原子半径的大小顺序为rX>rY>rZ>rW>rQ | |
| C. | Y和Z形成了共价化合物 | |
| D. | 元素W周期表中的位置是第三周期,第VI主族 |
 ;天然气的主要成分为CH4.(写化学式).
;天然气的主要成分为CH4.(写化学式). .
.