题目内容
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为__________洪特规则内容_____________
泡利不相容原理内容______________________
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__________I1(Cu)(填“大于”或“小于”)。原因是__________
(3)ZnF2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________g·cm-3(列出计算式)。
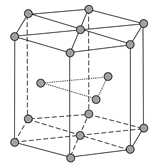
【答案】1s22s22p63s23p63d104s2或[Ar]3d104s2 原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低 每个原子轨道上最多只能容纳两个自旋状态不同的电子 大于 Zn核外电子排布为全满稳定结构,较难失电子 离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主、极性较小 六方最密堆积(A3型) 12 
【解析】
(1)Zn原子核外有30个电子,分别分布在1s、2s、2p、3s、3p、3d、4s能级上,其核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,洪特规则是指原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低,而泡利原理是指每个原子轨道上最多只能容纳两个自旋状态不同的电子,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低;每个原子轨道上最多只能容纳两个自旋状态不同的电子;
(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn,故答案为:大于;Zn核外电子排布为全满稳定结构,较难失电子;
(3)离子晶体熔沸点较高,熔沸点较高ZnF2,为离子晶体,离子晶体中含有离子键;根据相似相溶原理知,极性分子的溶质易溶于极性分子的溶剂,ZnF2属于离子化合物而ZnCl2、ZnBr2、ZnI2为共价化合物,ZnCl2、ZnBr2、ZnI2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶,故答案为:离子键;ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小;
(4)金属锌的这种堆积方式称为六方最密堆积,Zn原子的配位数为12,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(6×
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(6×![]() )×3×c]cm3,晶胞密度=
)×3×c]cm3,晶胞密度= ,故答案为:六方最密堆积(A3型);12;
,故答案为:六方最密堆积(A3型);12; 。
。

【题目】实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是

项选 | X | Y | Z | 结论 |
A | Br2 | 苯 | NaOH 溶液 | 苯与溴发生取代反应 |
B | SO2 | 酸性KMnO4溶液 | NaOH 溶液 | 二氧化硫具有漂白性 |
C | HCl | Na2SiO3溶液 | NaCl 溶液 | Cl 的非金属性强于Si |
D | CH2= CH2 | Br2 的CCl4溶液 | AgNO3溶液 | 乙烯与Br2发生加成反应 |
A.AB.BC.CD.D