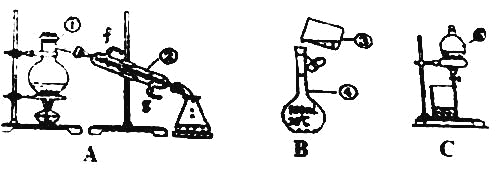��Ŀ����
����Ŀ��ij��̬��A����״���µ��ܶ�Ϊ1.25g/L��B��D���������г������л��D�ܸ�̼�����Ʒ�Ӧ��E����ζ������֮���ת����ϵ����ͼ��ʾ��


��1��A�ĵ���ʽΪ ��D�й����ŵ�����Ϊ ��
��2����AΪԭ�������ϳɸ߷��ӻ�����Ļ�ѧ����ʽΪ ����Ӧ������ ��
��3����Ӧ����Cu�������������½��У���ʵ��IJ����ǽ�������ͭ˿���ھƾ����ϼ��ȣ���ͭ˿��Ϊ��ɫʱ��Ѹ�ٽ�����뵽װ��B���Թ��У�����ͼ��ʾ�����۲쵽�������� ���ظ�����2��3�Ρ�д����������Ӧ����ʽ ��
��4��B��D��Ũ�����������ʵ�ַ�Ӧ����ʵ��װ������ͼ��ʾ��

���Թ�1��ʵ�ַ�Ӧ���Ļ�ѧ����ʽΪ ��
����Ӧ��ʼʱ�þƾ��ƶ��Թ�С����ȵ�ԭ���ǣ� ������֪���������ķе�Ϊ77�����Ҵ��ķе�Ϊ78.5��������ķе�Ϊ117.9����
���𰸡���1��![]() ���Ȼ���
���Ȼ���
��2��nCH2 = CH2![]()
![]() CH2��CH2
CH2��CH2![]() �� �Ӿ۷�Ӧ��
�� �Ӿ۷�Ӧ��
��3��ͭ˿�ɺ�ɫ���ɫ�� 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
��4����CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
����ֹ�����¶ȹ���ʹ��Ӧ����������ַ�Ӧ����������ͬʱ��ֹ���������ѵ����ɡ�
��������
�����������̬��A�ڱ���µ��ܶ�Ϊ1.25g/L����Ħ������=1.25g/L��22.4L/mol=28g/mol��A��һ����Ҫ�Ļ���ԭ�ϣ����IJ���ͨ����������һ������ʯ�ͻ���ˮƽ����A����ϩ��B��D���������г������л����ϩ��ˮ�����ӳɷ�Ӧ����B����B���Ҵ����Ҵ���������Ӧ����C����C����ȩ��C��������Ӧ����D��D�����ᣬ�Ҵ������ᷴӦ����EΪ������������AΪ��Ҫԭ�Ϻϳɸ߷��ӻ������ø߷��ӻ������Ǿ���ϩ��
��1��AΪ��ϩ������ʽΪ![]() ��DΪ���ᣬ���������Ȼ����ʴ�Ϊ��
��DΪ���ᣬ���������Ȼ����ʴ�Ϊ��![]() ���Ȼ���
���Ȼ���
��2������ϩΪԭ���ϳɾ���ϩ�Ļ�ѧ����ʽΪnCH2 = CH2![]()
![]() CH2��CH2
CH2��CH2![]() ����Ӧ����Ϊ�Ӿ۷�Ӧ���ʴ�Ϊ��nCH2 = CH2
����Ӧ����Ϊ�Ӿ۷�Ӧ���ʴ�Ϊ��nCH2 = CH2![]()
![]() CH2��CH2
CH2��CH2![]() ���Ӿ���Ӧ��
���Ӿ���Ӧ��
��3����������ͭ˿���ھƾ����ϼ��ȣ���ͭ˿��Ϊ��ɫʱ��Ѹ�ٽ�����뵽װ���Ҵ����Թ�����ͭ˿�ɺ�ɫ���ɫ����������Ӧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO + 2H2O���ʴ�Ϊ��ͭ˿�ɺ�ɫ���ɫ�� 2CH3CH2OH+O2
2CH3CHO + 2H2O���ʴ�Ϊ��ͭ˿�ɺ�ɫ���ɫ�� 2CH3CH2OH+O2![]() 2CH3CHO + 2H2O��
2CH3CHO + 2H2O��
��4�����Թ�1����Ӧ���Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+ H2O���ʴ�Ϊ��CH3COOH+CH3CH2OH
CH3COOCH2CH3+ H2O���ʴ�Ϊ��CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O��
CH3COOCH2CH3+H2O��
����Ӧ��ʼʱ�þƾ��ƶ��Թ�С�������������ֹ�����¶ȹ���ʹ��Ӧ����������ַ�Ӧ����������ͬʱ��ֹ���������ѵ��������ʴ�Ϊ����ֹ�����¶ȹ���ʹ��Ӧ����������ַ�Ӧ����������ͬʱ��ֹ���������ѵ�������