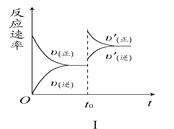
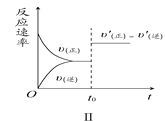
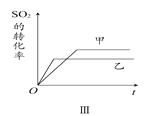
题目内容
【题目】常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸体积关系如右图所示。下列有关叙述错误的是
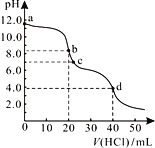
A. a点溶液呈碱性的原因用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. b点处的溶液中c(Na+)-2c(CO32-)=c(HCO3-)+c(Cl-)
C. 滴定过程中使用酚酞作为指示剂比石蕊更准确
D. d点处溶液中水电离出的c(H+)小于c点处
【答案】B
【解析】 A、a点是Na2CO3溶液,因CO32-水解而呈碱性,且一般只写第一步的水解方程式,所以A正确;B、根据b点溶液的pH=8可知,其溶液为等物质的量的NaCl和NaHCO3溶液,根据物料守恒可得c(Na+) —c(CO32-)=c(HCO3-)+c(Cl-) +c(H2CO3),若按电荷守恒,b处溶液中c(OH-)> c(H+),则c(Na+) >2c(CO32-)+c(HCO3-)+c(Cl-),不能确定c(Na+)-2c(CO32-)=c(HCO3-)+c(Cl-),所以B错误;C、Na2CO3与盐酸的反应分两步进行,第一步生成NaHCO3,溶液呈弱碱性,所以用酚酞作指示剂,也能求得Na2CO3的浓度,而石蕊的变色范围大,颜色变化不明显,所以不能用作指示剂,故C正确;由图象可知d处溶液呈弱酸性,抑制了水的电离,而c处溶液呈中性,对水的电离没有影响,所以D正确。本题正确答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。