题目内容
某无色溶液中放人铝片后有氢气产生,则下列离子在该溶液中肯定可以大量存在的是 ( )
| A.Na+ | B.Mg2+ | C.OH- | D.HCO3- |
A
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。注入某无色溶液中放人铝片后有氢气产生,这说明该溶液可能显酸性,也可能显碱性。如果显酸性,则OH-、HCO3-都不能大量共存。如果显碱性,则Mg2+、HCO3-都不能大量共存,因此答案选A。
点评:该题的关键是根据单质铝的性质,既能和酸反应生成氢气,也能和强碱溶液反应生成氢气,得出该无色溶液的酸碱性,然后依据离子共存的问题进行分析判断即可。

练习册系列答案
相关题目
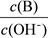 ②
②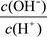 ③c(H+)
③c(H+) 下列各组离子可能大量共存的是( ):
下列各组离子可能大量共存的是( ):