题目内容
3. 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.(1)图中的Ⅱ是电解池的阳极(填“阴极”或“阳极”);
(2)求原CuSO4溶液的物质的量浓度.
分析 刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒.
解答 解:(1)电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,故答案为:阳;
(2)电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,Ⅱ曲线中由t2时生成氧气为112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
答:CuSO4的物质的量浓度均为0.1mol/L.
点评 本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意把握电极反应式的书写、对图象的解读为解该题的关键,题目难度中等.

 字词句段篇系列答案
字词句段篇系列答案| A. | CH4 | B. | C2H4 | C. | C6H14 | D. | C2H2 |
| A. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| B. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ |
| A. | 同一时间内消耗 2n mol X的同时生成 n mol Z | |
| B. | c(X):c(Y):c(Z)=2:1:1 | |
| C. | 容器内气体的总物质的量不再变化 | |
| D. | 容器内原子总数不再发生变化 |
| A. | v(NO)=0.01mol•(L•s)-1 | B. | v(NO)=0.02mol•(L•s)-1 | ||
| C. | v(NH3)=0.1mol•(L•s)-1 | D. | v(NH3)=0.2mol•(L•s)-1 |
| A. | 具有较高能量的分子是活化分子 | |
| B. | 活化分子间的碰撞一定是有效碰撞 | |
| C. | 不同化学反应需要的活化能有可能差别很大 | |
| D. | 反应的活化能大小不会影响化学反应速率 |
 利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.
利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.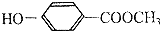 的同分异构体:
的同分异构体: