题目内容
【题目】在室温下,下列叙述正确的是
A.将1mL1.0×10-5mol/L盐酸稀释到1000mL,溶液的pH=8
B.用pH=1的盐酸分别中和1mL pH=13的NaOH溶液和氨水,NaOH消耗盐酸的体积大
C.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-)
D.室温下,向0.20 mol/L NH4HCO3中通入CO2至溶液呈中性:c(NH4+)=c(HCO3—)+2c(CO32—)
【答案】D
【解析】
A. 盐酸稀释后还是酸,溶液的pH始终小于7;
B. NaOH是强碱,氨水是弱碱,pH相同的NaOH和氨水,溶液浓度氨水>NaOH,;碱的浓度越大,消耗盐酸越多;
C. pH=2的盐酸中c(H+)=c(Cl-)=0.01mol/L,pH=1的硫酸中c(SO42-)=![]() c(H+)=0.05mol/L;
c(H+)=0.05mol/L;
D. 溶液呈中性,有c (H+)= c (OH-),溶液中存在电荷守恒,根据电荷守恒进行判断;
A. 盐酸稀释后还是酸,溶液的pH始终小于7,不可能变成8,A项错误;
B. NaOH是强碱,氨水是弱碱,pH相同的NaOH和氨水,溶液浓度氨水>NaOH,;碱的浓度越大,消耗盐酸越多,因此氨水消耗的盐酸更多,B项错误;
C. pH=2的盐酸中c(H+)=c(Cl-)=0.01mol/L,pH=1的硫酸中c(SO42-)=![]() c(H+)=0.05mol/L,因此c(Cl-)<c(SO42-),C项错误;
c(H+)=0.05mol/L,因此c(Cl-)<c(SO42-),C项错误;
D. 根据电荷守恒可知c (H+)+ c (NH4+)=c (OH-)+c (HCO3-)+2c (CO32-),溶液呈中性,有c (H+)= c (OH-),因此c (NH4+)=c (HCO3-)+2c (CO32-),D项正确;
答案选D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
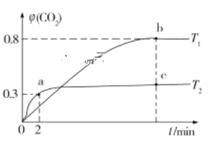
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等