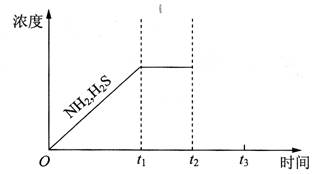
题目内容
241.0 mL
在稀释过程中SO3与水作用生成硫酸,反应方程式如下:
SO3+H2O===H2SO4。
(1)1 L发烟硫酸的总质量为1000×1.95="1950" g,其中SO3的质量为1950×30%="585" g,n(SO3)=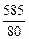 ="7.3" mol,SO3转化成H2SO4所消耗水的质量m1(H2O)=18×7.3="131.6" g。
="7.3" mol,SO3转化成H2SO4所消耗水的质量m1(H2O)=18×7.3="131.6" g。
(2)混合物原H2SO4的质量为1950-585="1365" g,由SO3转化生成H2SO4的质量为98×7.3="716.6" g,溶液中H2SO4的总质量为m总(H2SO4)=1365+716.6="2081.6" g
(3)假设稀释后总溶液的质量为x,则有
2081.6=95%·x,x="2191" g,应补加水的质量m2(H2O)=2191-2081.6="109.4" g。
(4)整个稀释过程中应加入水的质量m总(H2O)=m1(H2O)+m2(H2O)="131.6" g+109.4g
=241.0g。
SO3+H2O===H2SO4。
(1)1 L发烟硫酸的总质量为1000×1.95="1950" g,其中SO3的质量为1950×30%="585" g,n(SO3)=
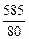 ="7.3" mol,SO3转化成H2SO4所消耗水的质量m1(H2O)=18×7.3="131.6" g。
="7.3" mol,SO3转化成H2SO4所消耗水的质量m1(H2O)=18×7.3="131.6" g。(2)混合物原H2SO4的质量为1950-585="1365" g,由SO3转化生成H2SO4的质量为98×7.3="716.6" g,溶液中H2SO4的总质量为m总(H2SO4)=1365+716.6="2081.6" g
(3)假设稀释后总溶液的质量为x,则有
2081.6=95%·x,x="2191" g,应补加水的质量m2(H2O)=2191-2081.6="109.4" g。
(4)整个稀释过程中应加入水的质量m总(H2O)=m1(H2O)+m2(H2O)="131.6" g+109.4g
=241.0g。

练习册系列答案
相关题目