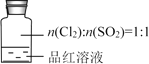题目内容
【题目】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如: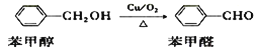
①苯甲醇中碳原子的杂化类型是___________。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用![]() 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,![]() 越大。分裂能(
越大。分裂能(![]() )Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
)Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
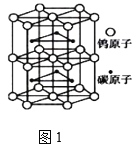
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________。
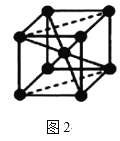
(5)Fe的一种晶体如图2所示,设阿伏加德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___(只列出计算式)
【答案】[Ar]3d104s1 sp2、sp3 高 O>C>H < 原子晶体 ![]()
【解析】
(1)注意铜的电子排布的特殊性,保证3d轨道全满;
(2)注意苯环的碳的杂化方式与侧链上碳的杂化方式不同;醇的沸点相对偏高是因为形成了分子间氢键;电负性大小是对元素非金属性强弱的直接度量;
(3)用好题给信息中分裂能强弱的影响因素;
(4)所给晶胞不必采用均摊法分析,直接根据性质进行预测即可;
(5)采用均摊法算出每个晶胞中的铁原子数,利用密度公式求算。
(1)基态铜原子的电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)①苯甲醇中苯环上的碳采取sp2杂化,侧链碳采取sp3杂化;
②由于苯甲醇能形成分子间氢键而苯甲醛不能,所以苯甲醇的沸点高于苯甲醛;
③元素的非金属性越强,电负性越大。C、O、H的电负性由大到小的顺序是O>C>H;
(3)Co(H2O)62+和Co(H2O)63+相比较,前者的中心离子电荷数小,离子半径:Co2+大于Co3+,所以前者的分裂能小;
(4)该晶体的熔点很高,硬度大,符合原子晶体的特点,故预测该晶体类型是原子晶体;
(5)在所给的铁晶胞中,与一个铁原子最近的铁原子的距离为立方体的边长的![]() ,这样的原子有8个,所以铁的配位数为8,因为铁原子的半径是rcm,根据该铁的晶胞的结构可以知道,晶胞的边长为
,这样的原子有8个,所以铁的配位数为8,因为铁原子的半径是rcm,根据该铁的晶胞的结构可以知道,晶胞的边长为![]() ,在每个晶胞中含有铁原子的数目为
,在每个晶胞中含有铁原子的数目为![]() ,设铁原子的相对原子质量为M,根据密度
,设铁原子的相对原子质量为M,根据密度![]() 可得
可得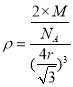 ,所以
,所以![]() 。
。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
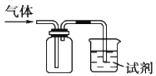
选项 | 试剂 | 现象 | 结论 |
A | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
B | 品红溶液 | 溶液褪色 | SO2有氧化性 |
C | 滴有酚酞的NaOH溶液 | 溶液褪色 | SO2有还原性 |
D | H2S水溶液 | 溶液变浑浊 | SO2有氧化性 |
A.AB.BC.CD.D
【题目】依据下列实验现象,所得结论不正确的是
实验 | 实验现象 |
| ①品红溶液红色褪去,经检验溶液中含有SO42- ②加热褪色后的溶液至沸腾,未见颜色恢复,有气体溢出,可使蓝色石蕊试纸变红,遇淀粉碘化钾试纸,无明显变化。 |
A. 品红溶液褪色是氯水漂白所致
B. 集气瓶中发生了反应:Cl2 + SO2 + 2H2O H2SO4 + 2HCl
C. 依据现象②可确定产生的气体为SO2
D. 检验SO42-的试剂为:盐酸、BaCl2溶液