题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g)ΔH 1=+489.0 kJ·mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①CO的平衡转化率(α)与温度、压强的关系如下图所示。
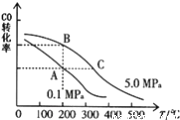
B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”).
②某温度下,将2.0molCO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
【答案】(1)Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H =-28.5 kJ·mol-1(2分)
(2)CO + 4OH-―2e-=CO32-+ 2H2O(2分)
(3)①>(2分)②75%(2分) 1.3L/mol(2分)
【解析】
试题分析:(1)Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g)ΔH 1=+489.0 kJ·mol-1 ①,C(s)+CO2(g)=2CO(g)ΔH 2 =+172.5 kJ·mol-1 ②,根据盖斯定律由①-②×3,得到热化学方程式为Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H =-28.5 kJ·mol-1。
(2)CO燃料电池以KOH溶液为电解质溶液时,负极上是CO发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即该电池的负极反应式为CO + 4OH-―2e-= CO32-+ 2H2O 。
(3)①根据图中CO的平衡转化率(α)与温度、压强的关系,当温度升高时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,平衡常数减小,则K(B)> K(C);
②将2.0molCO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率0.75÷1×100%=75%,此温度下的化学平衡常数K=0.75÷(0.25×1.52)≈1.3。
