题目内容
甲同学设计以下实验制取氧气和氧化铜。(1)制取氧气
①用20%的H2O2溶液,通过反应2H2O2![]() 2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
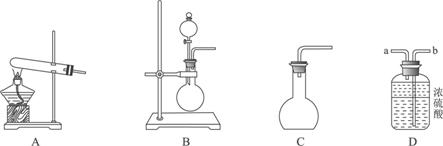
②与气体发生装置相连接的D装置的导管口是_____________;
③为了能使产生的氧气被充分干燥,可采取的操作是______________________________。
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2![]() 2CuO,②4CuO
2CuO,②4CuO![]() 2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有_____________,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是__________≤n<__________,则粉末X中含有Cu2O,其物质的量是__________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
解析:本题结合氧气和氧化铜的制法,对有关实验装置和实验现象进行了定性的分析,并且对所得产物从定性和定量两个方面进行全面的考查。
答案:(1)①B ②b ③控制分液漏斗活塞,让液体慢慢滴入烧瓶中,使产生的气体缓缓通过D装置
(3)红色不溶于水的固体生成 ![]()
![]()
![]()
向粉末X中加入足量浓HNO3,若有红棕色气体产生,则说明固体中含有Cu2O;反应的离子方程式为:CuO+2H+====Cu2++H2O,Cu2O+6H++2![]() ====2Cu2++2NO2↑+3H2O
====2Cu2++2NO2↑+3H2O

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
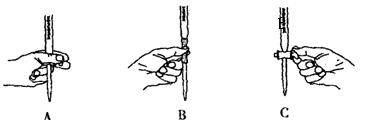
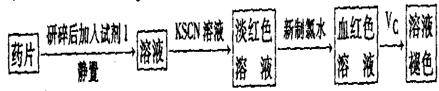
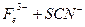

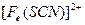 。
。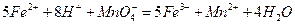 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。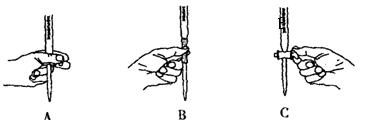
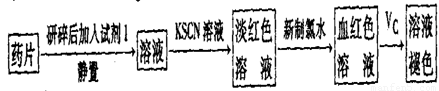
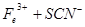
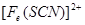 。
。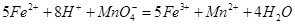 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。