题目内容
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答: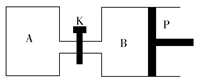
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为________,A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”“<”或“=”)________A。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(1)0.01 mol/(L·s)
(2)③④ (3)75% < 1.75a
解析

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
| t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)
 H4SiO4(aq) ΔH
H4SiO4(aq) ΔH①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
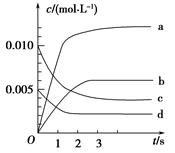
(2)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。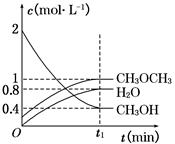
 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有 mol A,此时C的物质的量浓度为 。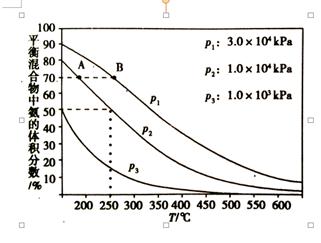

 2SO2(g)+ O2(g) 2SO3(g),其中△H < 0 ,当反应达到平衡时,活塞位置如图2所示:
2SO2(g)+ O2(g) 2SO3(g),其中△H < 0 ,当反应达到平衡时,活塞位置如图2所示:
 2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题:
2NH3(g) △H<0,起始 充入amol N2、bmol H2, 达到平衡后,N2、H2、NH3的物质的量分别为1 mol、3 mol、10 mol,回答下列问题: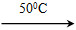 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q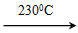 Ni(s)+4CO(g)
Ni(s)+4CO(g)