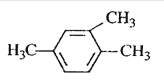
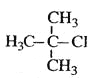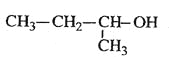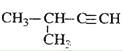题目内容
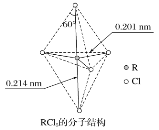
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表),经X射线衍射测得R的局部结构如图所示,下列说法正确的是( )
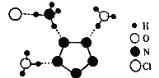
A.R中两种阳离子的中心原子的杂化轨道类型相同,但化学键类型不同
B.1molR中σ键总数为15个
C.N5-中参与形成的大π键电子数为6个
D.已知图中虚线代表氢键,其中一个表示为(NH4)N﹣H···Cl,则化合物R中共有4个不同类型氢键
【答案】C
【解析】
A.R中阳离子为NH4+中心原子为sp3杂化轨道,形成3个σ键和1个配位键,另一种阳离子为H3O+,中心原子为sp3杂化轨道,形成2个σ键和1个配位键键,所以二者中心原子的杂化轨道类型相同,化学键类型相同,故A错误;
B.据图可知1molR中σ键总数为15NA,故B错误;
C.N5-中每个N形成两条共价键,pz轨道留有一个单电子,5个N的5个pz轨道交盖形成离域大π键;N5-的价电子总数为5×5+1=26,σ键个数为5,每个氮原子有1对孤电子对,且未参与形成大π键,所以参与形成大π键的电子数为26-5×2-5×2=6,故C正确;
D.据图可知除(NH4+)N-H···Cl外还有(H3O+)O-H···N(N5-)、(NH4+)N-H···N(N5-)两种氢键,共三种,故D错误;
故答案为C。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。