题目内容
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAl02+6Ag+H20,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知: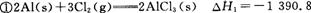 kJ/mol
kJ/mol
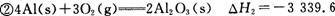 kJ/mol
kJ/mol
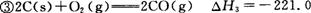 kJ/mol
kJ/mol
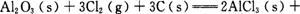
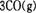 的ΔAH= 。
的ΔAH= 。
 Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
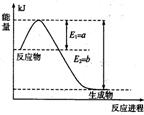
(1)右图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为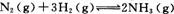 在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 ,有3 m01FeS2参加反应,转移 mol电子。
,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
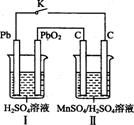 Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
Ⅰ(1)Al3++3e-=Al ;阳极; 降低氧化铝熔点
(2) Al+4OH--3e-=AlO2-+2H2O;变大
-52.5KJ/mol Ⅱ. ΔH=-2(b-a)KJ/mol (2)AB Ⅲ (1)32 (2)
ΔH=-2(b-a)KJ/mol (2)AB Ⅲ (1)32 (2)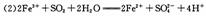
Ⅳ.Mn2+一2e一+2H20=MnO2+4H+ Pb+Pb02+2H2S04=2PbSO4+2H20 2 mol 87

 出彩同步大试卷系列答案
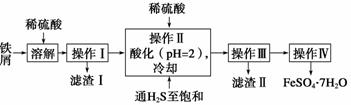
出彩同步大试卷系列答案绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_______________________________________________________。
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、___________________________。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________(填仪器名称)。
②判断此滴定实验达到终点的方法是_____________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_______________________________。