题目内容
【题目】用下列实验装置进行相应的实验,能够达到实验目的是( )
A.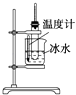 实验室制取少量的硝基苯
实验室制取少量的硝基苯
B.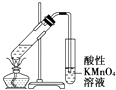 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C.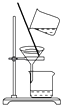 分离乙酸乙酯、碳酸钠和水的混合物
分离乙酸乙酯、碳酸钠和水的混合物
D.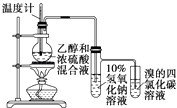 证明乙醇、浓硫酸共热生成乙烯
证明乙醇、浓硫酸共热生成乙烯
【答案】D
【解析】解:A.制备硝基苯应水浴加热,温度计测定水温度,加热至50℃~60℃,故A错误; B.溴乙烷、NaOH、乙醇溶液发生消去反应生成乙烯,但乙醇挥发,乙醇也能被高锰酸钾氧化,不能说明乙烯的生成,故B错误;
C.乙酸乙酯、碳酸钠和水的混合物,分层,乙酸乙酯在上层,则利用分液法分离,不能利用过滤分离,故C错误;
D.乙醇和浓硫酸混合加热到170°C发生消去反应生成乙烯,过程中副反应为浓硫酸脱水性得到碳和浓硫酸加热反应生成二氧化碳和二氧化硫,二氧化硫具有还原性和溴单质发生反应,检验乙烯前需要除去二氧化硫,装置中乙烯发生装置正确,通过氢氧化钠溶液吸收生成的二氧化硫和二氧化碳,剩余气体通过溴的四氯化碳溶液褪色证明生成乙烯,实验装置能够达到实验目的,故D正确;
故选D.

【题目】实验室以绿矾(FeSO47H2O)为铁源制备补铁剂甘氨酸亚铁[(NH2 CH2COO)2 Fe〕.有关物质性质:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
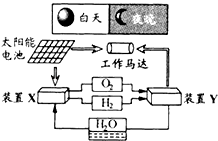
I.制备FeCO3:将0.10mol绿矾溶于水中,加入少量铁粉,边搅拌边缓慢加入1.1molL﹣1NH4HCO3溶液200mL.反应结束后过滤并洗涤沉淀.
II.制备(NH2 CH2 COO) 2Fe:实验装置如图(夹持和加热仪器已省略),利用A中反应将C中空气排净,再将上述沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,滴入柠檬酸并加热.反应结束后过滤,滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品.
回答下列问题:
(1)实验I中:铁粉的作用是;生成沉淀的离子方程式为 .
(2)实验II中:
①装置B中试剂为 .
②当C中空气排净后,应停止滴加盐酸,打开止水夹 , 关闭止水夹
③装置D中Ca(OH)2的作用是 .
④柠檬酸可调节pH,体系pH与产率的关系如表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 5686. |
pH过低使产率下降的原因是;柠檬酸的作用还有(填序号).
a.作反应终点指示剂 b.防止二价铁被氧化 c.促进FeCO3溶解 d.作催化剂
⑤乙醇的作用是 .
⑥若产品的质量为m g,则产率为
(3)设计实验方案测定产品中二价铁含量(不必描述操作过程的细节): .
(已知产品中存在少量三价铁,且仅二价铁可以在酸性条件下被KMnO4、NaC1O或H2 O2定量快速氧化.)