题目内容
国家环保总局“环境监测公报”指出,减少SO2的排放和生活废水的处理是
我国“十一五”期间环境保护的主要任务.请回答下列问题:
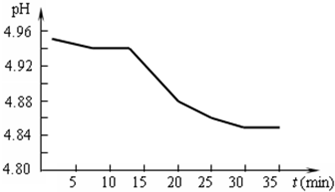
(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是______.
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
Sx、CO+
Sx=COS、2COS+SO2=2CO2+
Sx.其中COS(羰基硫)分子的电子式为______.
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为______.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式______.
我国“十一五”期间环境保护的主要任务.请回答下列问题:

(1)SO2的排放是造成酸雨的主要因素.某地区酸雨pH随时间的变化如右图所示.请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______.
(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应回收SO2,该技术较传统用NaOH溶液吸收及用H2SO4回收SO2处理方法的优点是______.
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2.该方法涉及到的化学反应为:SO2+2CO=2CO2+
| 1 |
| x |
| 1 |
| x |
| 3 |
| x |
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为______.若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液中加入甲醇,NO3-和甲醇转化为两种无毒气体.请写出加入甲醇后反应的离子方程式______.
(1)某地区酸雨pH随时间的变化分析,随时间增长,溶液PH减小,证明氢离子浓度增大,酸雨形成是二氧化硫溶于水生成亚硫酸,亚硫酸钡氧气氧化为硫酸,从弱酸变化为强酸,溶液中氢离子浓度增大,PH减小,反应的化学方程式为:2H2SO3+O2=2H2SO4;故答案为:2H2SO3+O2=2H2SO4;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染;
故答案为:既能回收利用SO2,又能得到复合肥磷铵;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价,结合原子结构写出电子式为:
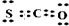
;
故答案为:
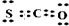
;
(4)氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用,常见的能使生活污水中悬浮物聚沉的物质有明矾、绿矾高铁酸盐等;消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液是硝酸溶液,具有强氧化性,加入甲醇,硝酸根离子和氢离子能氧化甲醇为无毒气体为二氧化碳,NO3-和甲醇转化为两种无毒气体,推断硝酸钡还原为氮气,反应的离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
故答案为:KAl(SO4)2?12H2O或 FeSO4?7H2O; 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
(2)采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,可作为肥料,减低污染,达到充分利用资源的目的,变废为肥,充分利用资源,降低污染;
故答案为:既能回收利用SO2,又能得到复合肥磷铵;
(3)C的非金属性小于O和S,结构式为O=C=S,C的化合价为+4价,结合原子结构写出电子式为:
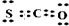
;
故答案为:
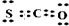
;
(4)氢氧化铝、氢氧化铁形成的胶体具有较大表面积能吸附悬浮杂质的作用,常见的能使生活污水中悬浮物聚沉的物质有明矾、绿矾高铁酸盐等;消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后在该酸性溶液是硝酸溶液,具有强氧化性,加入甲醇,硝酸根离子和氢离子能氧化甲醇为无毒气体为二氧化碳,NO3-和甲醇转化为两种无毒气体,推断硝酸钡还原为氮气,反应的离子方程式为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;
故答案为:KAl(SO4)2?12H2O或 FeSO4?7H2O; 6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O;

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
