题目内容
(15分)(2012?重庆)金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子.碳元素在周期表中的位置是 ,Q是 ,R的电子式为 .
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 .
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,过滤得SiC固体11.4g,滤液稀释到1L.生成氢气的离子方程式为 ,硅酸盐的物质的量浓度为 .
(4)下列叙述正确的有 (填序号).
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
(1)第二周期第ⅣA族;氧(或O); ;(2)过滤;水(或乙醇)(3)Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1(4)③④
;(2)过滤;水(或乙醇)(3)Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1(4)③④
【解析】
试题分析:(1)Q为氧,非极性分子R为CO2;
(2)将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应;
(3)根据反应的方程式计算生成Na2SiO3的物质的量,进而计算浓度;
(4))①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO;
②水晶属于原子晶体,而干冰属于分子晶体;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O.
【解析】
(1)由题给信息“碳与Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子”可推知Q为氧,非极性分子R为CO2.根据周期序数=电子层数,主族序数=最外层电子数可以确定碳在周期表中的位置是第二周期第ⅣA族,CO2的电子式为 ,故答案为:第二周期第ⅣA族;氧(或O);
,故答案为:第二周期第ⅣA族;氧(或O);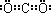 ;
;
(2)金刚石是不溶于CCl4的固体,CCl4是液体,将不溶性固体和液体分离通常采用的方法是过滤;由于Na可以与水(或乙醇)发生反应,而金刚石不与水(或乙醇)反应,所以除去粗产品中少量的钠可用水(或乙醇),
故答案为:过滤;水(或乙醇);
(3)根据硅与NaOH反应的化学方程式Si+2NaOH+H2O═Na2SiO3+2H2↑可写出其离子方程式为Si+2OH﹣+H2O═SiO32﹣+2H2↑;
计算溶液中硅酸盐的物质的量浓度需要根据化学方程式进行计算:
Si+2NaOH+H2O═Na2SiO3+2H2↑
28 g 1 mol 2 mol
m(Si) n1(Na2SiO3) 0.1 mol
m(Si)=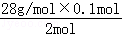 =1.4g,
=1.4g,
n1(Na2SiO3)=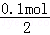 =0.05 mol,
=0.05 mol,
粗产品中SiO2的质量为m(SiO2)=20.0g﹣11.4g﹣1.4 g=7.2 g
SiO2+2NaOH═Na2SiO3+H2O
60g 1mol
2g n2(Na2SiO3)
n2(Na2SiO3)=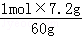 =0.12mol,
=0.12mol,
则n(Na2SiO3)=n1(Na2SiO3)+n2(Na2SiO3)=0.12mol+0.05mol=0.17mol,
硅酸盐的物质的量浓度为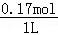 =0.17mol/L,
=0.17mol/L,
故答案为:Si+2OH﹣+H2O═SiO32﹣+2H2↑;0.17 mol?L﹣1;
(4)①Na还原CCl4的反应属于置换反应,但Cl2与H2O反应生成HCl和HClO,不是置换反应,故①错误;
②水晶属于原子晶体,而干冰属于分子晶体,熔化时克服粒子间作用力的类型不相同,故②错误;
③Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,则可用于推断Si与S的非金属性强弱,故③正确;
④钠、锂分别在空气中燃烧,生成的氧化物分别为Na2O2、Li2O,阴阳离子数目比均为1:2,故④正确.
故答案为:③④.