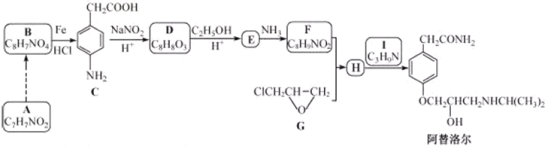
题目内容
【题目】某工厂废料中含有一定量的单质银。该工厂设计回收单质银的工艺流程如下
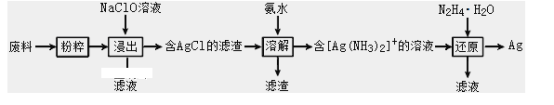
已知: i.NaClO在酸性条件下易分解,且NaClO氧化Ag的效果远强于NaClO3的ii.3NaClO![]() 2NaCl+NaClO3请回答下列问题
2NaCl+NaClO3请回答下列问题
(1)“粉碎”的目的为_____;
(2)“浸出”时,需加入适量NaCl并保持体系为碱性环境,其中需保持体系为碱性环境的原因为___,发生反应的离子方程式为______________;
(3)“浸出”时,所加 NaClO可用_____(填选项字母)代替,但此法的缺点是_______;
a.HNO3 b.NaCl c.Na2S
(4)“溶解”时,发生反应的离子方程式为______________。
(5)“还原”时,N2H4H2O对应的产物为N2.此反应中氧化剂与还原剂的物质的量之比为_____。
【答案】增大接触面积,提高后续银的浸出速率 防止NaClO分解成NaCIO3降低氧化效果 2Ag+ClO﹣+Cl﹣+H2O=2AgCl+2OH﹣ A 产生氮氧化物,污染环境 AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O 4:1
【解析】
回收银的流程:将粉碎的银废料在NaCl存在时在碱性条件下被NaClO氧化,生成的AgCl和氨水发生络合反应生成[Ag(NH3)2]+,然后用N2H4·H2O还原得到银。
(1)“粉碎”的目的为增大接触面积,提高后续银的浸出速率;
(2)NaClO在酸性条件下易分解为NaClO3,且NaClO氧化Ag的效果远强于NaClO3,所以“浸出”时,需加入适量NaCl并保持体系为碱性环境,发生反应的离子方程式为2Ag+ClO﹣+Cl﹣+H2O=2AgCl+2OH﹣;
(3)“浸出”时,NaClO起到了氧化剂的作用,虽然硝酸也有强氧化性,可以氧化银,但硝酸的还原产物是NO或NO2,污染环境;
(4)“溶解”时,发生了类似制取银氨溶液的反应,故反应的离子方程式为AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O ;
(5)“还原”时,N2H4H2O对应的产物为N2,氮的化合价从-2价升高到0价,1mol还原剂失去4mol电子,[Ag(NH3)2]+被还原为Ag,1mol氧化剂得到1mol电子,根据电子守恒,此反应中氧化剂与还原剂的物质的量之比为4:1。

【题目】下列实验能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较S和Si的非金属性强弱 | 向Na2SiO3溶液中通入SO2产生白色沉淀 |
B | 除去NaHCO3溶液中的杂质Na2CO3 | 向混合液中通入足量的CO2气体 |
C | 检验某盐是否为铵盐 | 试样 |
D | 验证H2O2和Fe3+的氧化性 强弱 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
A. A B. B C. C D. D
【题目】溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
颜色状态 | 无色液体 | 深红棕色液体 | 无色液体 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中的溶解性 | 难溶 | 微溶 | 难溶 |
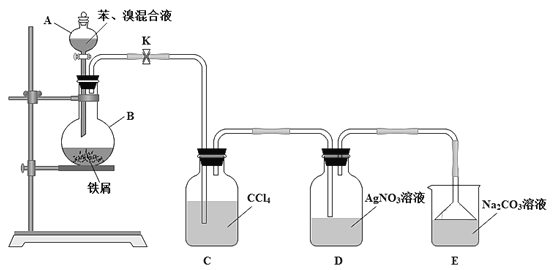
(1)仪器A的名称为____。
(2)反应器B中发生的主要有机反应的化学方程式是___。
(3)下列关于该实验操作或叙述错误的是___(填字母序号)。
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__,要进一步提纯,下列操作中必须的是___。
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___(计算结果保留三位有效数字)。