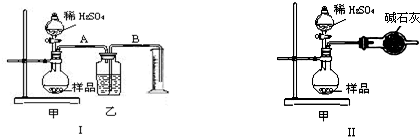
题目内容
某校化学兴趣小组的同学拟用以下流程研究工业合成氨以及氨氧化法制硝酸,氨氧化法制硝酸最关键的一步是让氨气与氧气在有催化剂存在的高温条件下反应生成NO,请据此回答下列问题: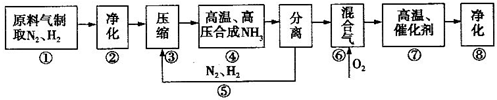
(1)流程第④步用于制取氨气,该步的化学方程式为
(2)产生的氨气与过量的氧气混合后在第⑦步反应,用酒精喷灯加热,则氨催化氧化的化学方程式是
(3)若用一大试管收集产生的气体48mL,然后将此大试管倒置于盛满水的水槽中,保持温度和压强不变,待液面稳定后,容器中剩余24mL气体,则原混合气体的组成为
分析:(1)根据第④步是氮气和氢气在高温、高压以及催化剂的条件下生成氨气来书写化学方程式;
(2)根据氨催化氧化是氨气和氧气在铂作催化剂和一定温度下反应生成一氧化氮和水;根据一氧化氮与氧气反应生成二氧化氮,二氧化氮红棕色气体;根据NO2为红棕色气体,N2O4为无色气体以及温度对平衡2NO2?N2O4△H<0的影响;
(3)由题意以及二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,可知气体的成分为二氧化氮和一氧化氮,利用差量法根据方程式3NO2+H2O=2HNO3+NO来计算各自的成分;
根据一氧化氮、氧气与水反应的方程式:4NO+3O2+2H2O=4HNO3来计算;
根据二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO以及一氧化氮、氧气与水反应的方程式:4NO2+O2+2H2O=4HNO3来计算;
(2)根据氨催化氧化是氨气和氧气在铂作催化剂和一定温度下反应生成一氧化氮和水;根据一氧化氮与氧气反应生成二氧化氮,二氧化氮红棕色气体;根据NO2为红棕色气体,N2O4为无色气体以及温度对平衡2NO2?N2O4△H<0的影响;
(3)由题意以及二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,可知气体的成分为二氧化氮和一氧化氮,利用差量法根据方程式3NO2+H2O=2HNO3+NO来计算各自的成分;
根据一氧化氮、氧气与水反应的方程式:4NO+3O2+2H2O=4HNO3来计算;
根据二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO以及一氧化氮、氧气与水反应的方程式:4NO2+O2+2H2O=4HNO3来计算;
解答:解:(1)第④步是氮气和氢气在高温、高压以及催化剂的条件下反应生成氨气,反应的化学方程式为:
N2+3H2
2NH3,
故答案为:N2+3H2
2NH3;
(2)氨催化氧化是氨气和氧气在铂作催化剂和一定温度下反应生成一氧化氮和水,化学方程式为:4NH3+5O2
4NO+6H2O;
NO与氧气反应生成NO2:2NO+O2=2NO2,NO2为红棕色气体,所以净化后收集到的气体为红棕色;
NO2气体中存在平衡2NO2?N2O4△H<0,收集到的气体浸入冰水中,温度降低,平衡正向移动,红棕色气体NO2转变为无色气体N2O4,所以试管内气体颜色变浅,
故答案为:4NH3+5O2
4NO+6H2O;NO与氧气反应生成红棕色的NO2;NO2气体中存在平衡2NO2?N2O4△H<0,收集到的气体浸入冰水中,温度降低,平衡正向移动,红棕色气体NO2转变为无色气体N2O4,所以试管内气体颜色变浅;
(3)由题意以及二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,可知气体的成分为二氧化氮和一氧化氮,
3NO2+H2O=2HNO3+NO△V
3 1 2
36mL 12mL 24mL
则原气体中二氧化氮的体积为36mL,一氧化氮的体积为48mL-36mL=12mL,所以反应后气体为一氧化氮,体积为24mL;
若在剩余24mL气体中通入24mLO2,发生反应:
4NO+3O2+2H2O=4HNO3
4 3
24mL 24mL
氧气过量,参加反应的氧气为18mL,过量的氧气为6mL,
原气体中二氧化氮的体积为36mL,一氧化氮的体积为12mL,原混合气体中通入氧气,先发生反应:
3NO2+H2O=2HNO3+NO
36mL 12mL
所以反应后一氧化氮的体积为24mL,后发生反应 4NO2+O2+2H2O=4HNO3,若要水将充满整个试管,则气体恰好反应:
4NO+3O2+2H2O=4HNO3
4 3
24mL 18mL
故答案为:36mLNO2和12mLNO;6mL;18;
N2+3H2
| 高温高压 |
| 催化剂 |
故答案为:N2+3H2
| 高温高压 |
| 催化剂 |
(2)氨催化氧化是氨气和氧气在铂作催化剂和一定温度下反应生成一氧化氮和水,化学方程式为:4NH3+5O2
| ||
NO与氧气反应生成NO2:2NO+O2=2NO2,NO2为红棕色气体,所以净化后收集到的气体为红棕色;
NO2气体中存在平衡2NO2?N2O4△H<0,收集到的气体浸入冰水中,温度降低,平衡正向移动,红棕色气体NO2转变为无色气体N2O4,所以试管内气体颜色变浅,
故答案为:4NH3+5O2
| ||
(3)由题意以及二氧化氮和水反应的方程式为:3NO2+H2O=2HNO3+NO,可知气体的成分为二氧化氮和一氧化氮,
3NO2+H2O=2HNO3+NO△V
3 1 2
36mL 12mL 24mL
则原气体中二氧化氮的体积为36mL,一氧化氮的体积为48mL-36mL=12mL,所以反应后气体为一氧化氮,体积为24mL;
若在剩余24mL气体中通入24mLO2,发生反应:
4NO+3O2+2H2O=4HNO3
4 3
24mL 24mL
氧气过量,参加反应的氧气为18mL,过量的氧气为6mL,
原气体中二氧化氮的体积为36mL,一氧化氮的体积为12mL,原混合气体中通入氧气,先发生反应:
3NO2+H2O=2HNO3+NO
36mL 12mL
所以反应后一氧化氮的体积为24mL,后发生反应 4NO2+O2+2H2O=4HNO3,若要水将充满整个试管,则气体恰好反应:
4NO+3O2+2H2O=4HNO3
4 3
24mL 18mL
故答案为:36mLNO2和12mLNO;6mL;18;
点评:本题主要考查了工业制硝酸的原理和化学计算,计算时依据反应方程式即可解答,难度中等.

练习册系列答案
相关题目