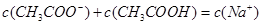题目内容
室温时,将浓度和体积分别为c1、v1的AOH碱溶液和c2、v2的HB酸溶液相混合,下列关于该混合溶液的叙述错误的是( )
分析:A.根据溶液中的溶质及酸碱的相对强弱判断;
B.任何电解质溶液中都存在电荷守恒;
C.中性溶液中,氢离子浓度等于氢氧根离子浓度,根据酸碱的相对强弱判断;
D.若二者的物质的量相等,根据物料守恒判断.
B.任何电解质溶液中都存在电荷守恒;
C.中性溶液中,氢离子浓度等于氢氧根离子浓度,根据酸碱的相对强弱判断;
D.若二者的物质的量相等,根据物料守恒判断.
解答:解:A.若pH>7且c1v1=c2v2,则二者恰好反应生成盐,生成的盐是强碱弱酸盐易水解而使溶液呈碱性,故A错误;
B.任何电解质溶液中都呈电中性,根据电荷守恒得c(A+)+c(H+)=c(B-)+c(OH-),故B正确;
C.若pH=7且V1=V2,如果酸和碱都是强电解质,则c2=c1,故C错误;
D.若V1=V2,C1=C2,二者的物质的量相等,如果酸是弱酸,碱是强碱,根据物料守恒得c(B-)+c(HB)=c(A+),故D正确;
故选AC.
B.任何电解质溶液中都呈电中性,根据电荷守恒得c(A+)+c(H+)=c(B-)+c(OH-),故B正确;
C.若pH=7且V1=V2,如果酸和碱都是强电解质,则c2=c1,故C错误;
D.若V1=V2,C1=C2,二者的物质的量相等,如果酸是弱酸,碱是强碱,根据物料守恒得c(B-)+c(HB)=c(A+),故D正确;
故选AC.
点评:本题考查了酸碱混合溶液定性判断,同时考查学生的发散思维能力及考虑问题的周全性,根据混合溶液的酸碱性及溶液中的溶质分析解答,难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述正确的是( )
| A.若pH>7,则一定是c1V1>c2V2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2=c1 |
| D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)+c(H+) |
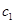 、
、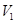 的NaOH溶液和
的NaOH溶液和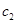 、
、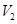 的
的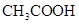 溶液相混合,下列关于该混合溶液的叙述错误的是 ( )
溶液相混合,下列关于该混合溶液的叙述错误的是 ( )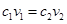
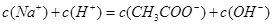
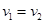 ,则一定是
,则一定是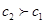
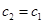 ,则
,则