题目内容
(1)今有2H2+O2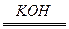 2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。
2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。
(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为____________、____________,(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?
(3)如把H2改为甲烷,KOH作导电物质,则电极反应式为____________。
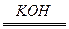 2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。
2H2O反应,构成燃料电池,则负极通的应是____________,正极通的应是____________,电极反应式为:______________、______________。(2)如把KOH改为稀H2SO4作导电物质,则电极反应式为____________、____________,(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?
(3)如把H2改为甲烷,KOH作导电物质,则电极反应式为____________。
(1)H2O2
负极:2H2+4OH--4e-====4H2O
正极:O2+2H2O+4e-====4OH-
(2)负极:2H2-4e-====4H+
正极:O2+4H++4e-====2H2O
(1)中pH变小,(2)中pH变大。
(3)负极:CH4+10OH--8e-
 +7H2O
+7H2O
正极:2O2+4H2O+8e-====8OH-
负极:2H2+4OH--4e-====4H2O
正极:O2+2H2O+4e-====4OH-
(2)负极:2H2-4e-====4H+
正极:O2+4H++4e-====2H2O
(1)中pH变小,(2)中pH变大。
(3)负极:CH4+10OH--8e-

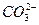 +7H2O
+7H2O正极:2O2+4H2O+8e-====8OH-
解决此题的关键是弄清原电池的有关概念,根据电池反应式可知H2在反应中被氧化,O2被还原;H2应在负极上反应,O2应在正极上反应。又因为是碱性溶液不可能有H+参加或生成,故负极反应为:2H2+4OH--4e-====4H2O,正极反应为:O2+2H2O+4e-====4OH-。若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加反应,也不可能有OH-生成,负极:2H2-4e-====4H+,正极:O2+4H++4e-====2H2O。由于前者在碱性条件反应,KOH量不变,但工作时H2O增多,故溶液变稀,pH将变小;而后者为酸溶液,H2SO4不变,水增多,溶液酸性变小,故pH将变大。如把H2改为甲烷用KOH作导电物质,则负极:CH4+10OH--8e-
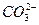 +7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。
+7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。

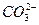 +7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。
+7H2O,正极:2O2+4H2O+8e-====8OH-,此时不会有CO2放出。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2H2O+O2↑
2H2O+O2↑
 2PbSO4+2H2O
2PbSO4+2H2O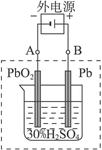
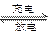 Cd+2NiO(OH)+2H2O。由此可见,该电池的负极材料是( )
Cd+2NiO(OH)+2H2O。由此可见,该电池的负极材料是( )